题目内容
10.一定条件下在水溶液中能大量共存的一组分子、离子是( )| A. | 中性溶液中:K+、Fe3+、NO3-、Cl- | |
| B. | 酸性溶液中:HClO、K+、SO42-、I- | |
| C. | 强碱性溶液中:Ca2+、K+、HCO3-、NO3- | |
| D. | 碱性溶液中:Na+、SO32-、NO3-、S2- |
分析 A.Fe3+水解呈酸性;
B.HClO具有强氧化性,可发生氧化还原反应;
C.碱性条件下HCO3-反应生成CO32-和水;
D.离子之间不发生反应.
解答 解:A.Fe3+水解呈酸性,不能大量存在于中性溶液中,故A错误;
B.HClO具有强氧化性,可与I-发生氧化还原反应,不能大量共存,故B错误;
C.碱性条件下HCO3-反应生成CO32-和水,不能大量共存,故C错误;
D.碱性条件下离子之间不发生反应,可大量共存,故D正确.
故选D.
点评 本题考查离子的共存,为高频考点,把握常见离子的反应及习题中的信息为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
1.室温下,在10mL0.1mol/LNH4Al(SO4)2溶液中,下列说法正确的是( )
| A. | 水电离出的c(H+)>10-7mol/L | |
| B. | c(Al3+)=c(NH4+)+c(NH3•H2O) | |
| C. | Ca2+、HCO3-、Na+、Cl-能在该溶液中大量共存 | |
| D. | 向该溶液中滴加10mL0.1mol/L NaOH溶液,无沉淀生成 |
18.化学与科技、生产、生活密切相关.下列说法正确的是( )
| A. | 气象环境报告中的“PM2.5”是一种新分子的描述 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量、 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 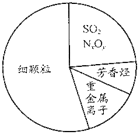 如图为雾霾的主要成分示意图,SO2和NxOy都属于酸性氧化物 |
5. 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
(1)N2H4-空气燃料电池是一种碱性人类电池,属于环保型电池,产物无污染.电解质溶液是20%~30%的KOH溶液.则人类电池放电时:正极的电极反应式是O2+2H2O+4e-=4OH-;负极的电极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(2)在波兰沦陷时,波尔为了防止诺贝尔奖章落入敌人手中,用王水将奖章溶解.然后再讲黄金从王水中提取处理,重新铸成奖章.王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属.铂溶于王水时产生[PtCl4]2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式3Pt+4NO3-+16H++18Cl-=3[PtCl6]2-+4NO↑+8H2O;
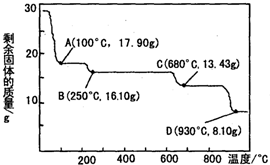
(3)硫酸锌被广泛应用于工农业生产和医药领域.取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示,在图中C点,680℃时所得固体的化学式为b(填字母序号).
a.ZnSO4•H2O b.Zn3O(SO4)2 c.ZnSO4 d.ZnO
(4)草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用.已知:
①(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”).
②当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7.请将该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)处理工业废水中的铁元素,一般做法都是使之完全转化成Fe3+,并转化成Fe(OH)3沉淀而除去.已知废水中c(Fe3+)=1.0×10-2mol•L-1,要想将其沉淀除去,则应调节溶液pH至少大于2.(已知常温下Fe(OH)3的Knp=1.0×10-38)
 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.(1)N2H4-空气燃料电池是一种碱性人类电池,属于环保型电池,产物无污染.电解质溶液是20%~30%的KOH溶液.则人类电池放电时:正极的电极反应式是O2+2H2O+4e-=4OH-;负极的电极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(2)在波兰沦陷时,波尔为了防止诺贝尔奖章落入敌人手中,用王水将奖章溶解.然后再讲黄金从王水中提取处理,重新铸成奖章.王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属.铂溶于王水时产生[PtCl4]2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式3Pt+4NO3-+16H++18Cl-=3[PtCl6]2-+4NO↑+8H2O;
(3)硫酸锌被广泛应用于工农业生产和医药领域.取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示,在图中C点,680℃时所得固体的化学式为b(填字母序号).
a.ZnSO4•H2O b.Zn3O(SO4)2 c.ZnSO4 d.ZnO
(4)草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用.已知:
| 电离方程式 | 电离常数 |
| H2C2O4?H++HC2O4- | K1=5.4×10-2 |
| HC2O4-?H++C2O42- | K2=5.4×10-5 |
| NH3•H2O?NH4++OH- | K=1.8×10-5 |
②当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7.请将该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)处理工业废水中的铁元素,一般做法都是使之完全转化成Fe3+,并转化成Fe(OH)3沉淀而除去.已知废水中c(Fe3+)=1.0×10-2mol•L-1,要想将其沉淀除去,则应调节溶液pH至少大于2.(已知常温下Fe(OH)3的Knp=1.0×10-38)
2.卤代烃有者广泛的应用.下列说法正确的是( )
| A. | 多氯代甲烷中分子结构为正四面体的是CH2Cl2 | |
| B. | 氯代甲烷在常温下均为液体 | |
| C. | 乙烯可用于制取1,2-二氯乙烷和乙醇,前者为加成反应,后者为水解反应 | |
| D. | 麻醉剂三氟氯溴乙烷(CF3CHClBr)的同分异构体有3种(不考虑立体异构) |
20.下列有关说法正确的是( )
| A. | 铁片镀锌时,铁片与外电源的正极相连 | |
| B. | 反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 0.1mol•L-1的CH3COOH溶液加水稀释,溶液的pH和其中水的电离程度均增大 | |
| D. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 |
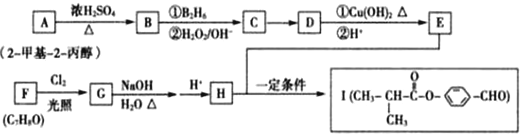
 .
. 、
、 .
.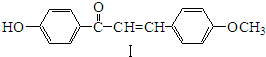

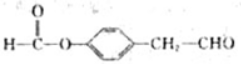
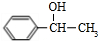 ,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为
,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为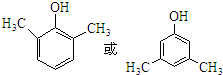 (任写一种).
(任写一种).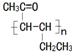 是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为
是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为 ,
,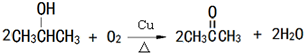 ,
, .
.