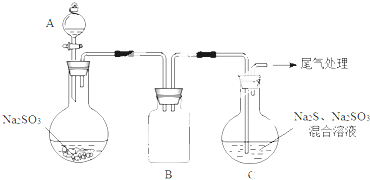
题目内容
15.能正确表示下列反应的离子方程式是( )| A. | 用氨水吸收过量的SO2:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| B. | Ca(HCO3)2 溶液中加入少量澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | NaClO溶液和FeCl2溶液混合:2ClO-+Fe2++2H2O=Fe(OH)2↓+2HClO |
分析 A.二氧化硫过量反应生成亚硫酸氢铵;
B.氢氧化钙少量反应生成碳酸钙和水;
C.碘离子还原性强于二价铁离子,氯气先氧化碘离子;
D.二价铁离子具有强的还原性,能够被次氯酸根离子氧化.
解答 解:A.用氨水吸收过量的SO2,离子方程式:NH3•H2O+SO2=NH4++HSO3-,故A错误;
B.Ca(HCO3)2 溶液中加入少量澄清石灰水,离子方程式:HCO3-+Ca2++OH-=CaCO3↓+H2O,故B正确;
C.氯气少量先氧化碘离子,离子方程式:2I-+Cl2=I2+2Cl-,故C错误;
D.NaClO溶液和FeCl2溶液混合,该离子反应为3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,选项AC为易错选项.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.${\;}_{92}^{235}$U是一种重要的核燃料,其中“92”是指该原子的( )
| A. | 中子数 | B. | 质子数 | C. | 电子数 | D. | 质量数 |
6.下列各项中表达正确的是( )
| A. | N2的结构式: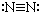 | B. | 钠离子电子式: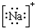 | C. | HCl的电子式: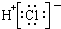 | D. | H-的结构示意图: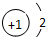 |
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl- | |
| B. | l.0 mol•L-1 NaClO溶液:Fe2+、K+、I-、Cl- | |
| C. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- | |
| D. | 在c(OH-)/c(H+)=1×1013的溶液:NH4+、Ca2+、C1-、K+ |
7.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 4.4g二氧化碳中含有的共用电子对数为0.4NA | |
| B. | 用二氧化硅制取单质硅时,当生成2.24 L气体(标准状况)时,得到2.8 g硅 | |
| C. | 标准状况下,0.5NA 个NO和0.5NA 个O2混合气体的体积约为22.4 L | |
| D. | 常温时0.1 mol•L-1 硝酸铵溶液中,NH4+和H+总数一定大于0.1NA |
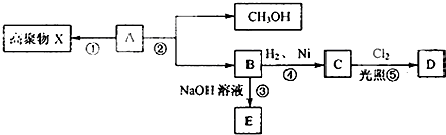 图所示的变化:
图所示的变化: CH2=CHCOOH+CH3OH.
CH2=CHCOOH+CH3OH. 元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.