题目内容
6.下列各项中表达正确的是( )| A. | N2的结构式: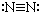 | B. | 钠离子电子式: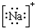 | C. | HCl的电子式: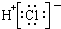 | D. | H-的结构示意图: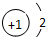 |
分析 A、写结构式,用一条短线代替一对共用电子;
B、钠离子为简单阳离子,直接用其离子符号表示其电子式,不需要用中括号;
C、氯化氢为共价化合物,分子中存在一个氢氯共用电子对,氯原子最外层一个为8个电子;
D、H-为H原子得到1个电子后形成的最外层2个电子的稳定结构的阴离子,据此解答即可.
解答 解:A、N2的电子式应去掉孤对电子,正确应为:N≡N,故A错误;
B、钠离子为简单阳离子,直接用其离子符号表示其电子式,不需要用中括号,正确的电子式为Na+,故B错误;
C、氯化氢属于共价化合物,分子中存在一个H-Cl键,氯原子最外层达到8个电子,氯化氢正确的电子式为 ,故C错误;
,故C错误;
D、H原子序数为1,得到1个电子,形成带1个负电荷的阴离子,结构示意图为: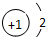 ,故D正确,故选D.
,故D正确,故选D.
点评 本题考查了化学用语的书写.对于化学用语,应熟练掌握,看清题目的要求,掌握化学用语书写的基本规则.

练习册系列答案
相关题目
14.下列化合物不能由单质直接生成的是( )
| A. | FeS | B. | CuS | C. | CuCl2 | D. | FeCl3 |
1.下列所描述的二氧化硫的一些化学性质中,体现二氧化硫作为还原剂的是( )
| A. | 通入溴水溶液使溴水褪色 | B. | 通入品红溶液中,使品红褪色 | ||
| C. | 溶于水形成不稳定的亚硫酸 | D. | 与碱液反应生成亚硫酸盐 |
11.下列离子方程式书写不正确的是( )
| A. | 氯水和碘化钾反应:Cl2+2I-=2Cl-+I2 | |
| B. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++Ag Cl↓ | |
| C. | 氢氧化钙溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 二氧化锰和盐酸制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
18.下列事实不能说明氯元素比硫元素非金属性强的是( )
| A. | Cl2能与H2S反应生成S | |
| B. | 溶于水时HCl是强酸,H2S是弱酸 | |
| C. | 受热时H2S能分解,HCl则不能 | |
| D. | Cl2与铁反应生成FeCl3,而S与铁反应生成FeS |
15.能正确表示下列反应的离子方程式是( )
| A. | 用氨水吸收过量的SO2:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| B. | Ca(HCO3)2 溶液中加入少量澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | NaClO溶液和FeCl2溶液混合:2ClO-+Fe2++2H2O=Fe(OH)2↓+2HClO |