题目内容
18.将a%的某物质的水溶液加热蒸发掉m g水(溶质不挥发、且蒸发过程无溶质析出),所得溶液体积V L,溶质的质量分数为蒸发前的2倍,设溶质的相对分子质量为M,则蒸发后所得溶液的物质的量浓度为$\frac{ma}{50MV}$mol•L-1.分析 将a%的某物质的水溶液加热蒸发掉mg水,溶质的质量分数为蒸发前的2倍,则蒸发后溶液的质量为mg,结合溶质的质量分数计算溶质的质量,根据n=$\frac{m}{M}$进而计算溶质的物质的量,利用c=$\frac{n}{V}$计算蒸发后所得溶液的物质的量浓度.
解答 解:设蒸发后溶液的质量为xg,浓缩蒸发溶质的质量不变,则:
(x+m)g×a%=x×2a%,
解得:x=m,
溶液中溶质的质量为:mg×2a%=2am% g,
溶质的相对分子质量为M,所以溶质的物质的量为:$\frac{2am%g}{Mg/mol}$=$\frac{2am%}{M}$mol,
蒸发后所得溶液体积为VL,所以蒸发后溶液的物质的量浓度为:c=$\frac{\frac{2am%}{M}}{VL}$$\frac{\frac{2am%}{M}mol}{VL}$=$\frac{ma}{50MV}$mol•L-1mol/L,
故答案为:$\frac{ma}{50MV}$mol•L-1.
点评 本题考查物质的量浓度计算、质量分数计算,题目难度中等,根据溶质质量分数变化确定溶质的质量为解答关键,注意掌握物质的量浓度、溶质质量分数的概念及计算方法.

练习册系列答案
相关题目
8.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 18g重水(D2O)中含有10NA个电子 | |
| B. | 22.4L一氯甲烷的分子数约为NA | |
| C. | 4.6g Na在氧气中完全反应生成Na2O和Na2O2,转移电子数为0.2NA | |
| D. | 25℃时,1L pH=14的Ba(OH)2溶液中,Ba2+数目为NA |
9.120mL含有2mol碳酸钠的溶液和200mL,1.5mol•L-1盐酸,不管将前者滴加入后者,还是将后者滴加入前者,下列叙述正确的是( )
| A. | Na2CO3溶液中加盐酸,无气体生成 | |
| B. | 盐酸中加入Na2CO3溶液,开始无气体,后有气体生成 | |
| C. | 无论怎么滴加,都有气体生成,且生成的气体一样多 | |
| D. | 无论怎么滴加,都有气体生成,且盐酸中滴加Na2CO3溶液产生的气体多 |
7.设NA表示阿伏德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,2.24LCH4含有的H原子数为0.1NA | |
| B. | 常温常压下,NA个CO2分子占有的体积为22.4L | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3NA | |
| D. | 2.4g金属镁变为镁离子时失去的电子数为0.2 NA |
8.某有机物的结构简式如图此有机物的说法不正确的是( )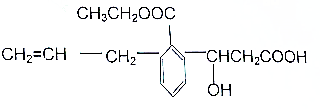

| A. | 可发生的反应类型有:取代、加成、消去、酯化、水解、氧化、中和、聚合 | |
| B. | 1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为2mol | |
| C. | 1mol该物质与Na、Na2CO3、NaHCO3反应时,所消耗的物质的量之比为2:1:2,产生的气体在标准状况下的体积比是2:1:2 | |
| D. | 该有机物属于芳香族化合物 |
 A、B、C、D、E五种元素位于周期表的前四周期,原子序数依次增大.A元素可以形成-1价离子,B、D最外层电子数都是电子层数的2倍,C原子基态时2p轨道内未成对电子数最多,E原子位于周期表ds区,且d轨道中的电子数与最外层电子数之比为5:1.
A、B、C、D、E五种元素位于周期表的前四周期,原子序数依次增大.A元素可以形成-1价离子,B、D最外层电子数都是电子层数的2倍,C原子基态时2p轨道内未成对电子数最多,E原子位于周期表ds区,且d轨道中的电子数与最外层电子数之比为5:1. ;
;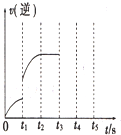 一定温度下体积为5L的密闭容器中发生可逆反应.
一定温度下体积为5L的密闭容器中发生可逆反应. .
.
