题目内容
8.设NA为阿伏加德罗常数的数值.下列说法正确的是( )| A. | 18g重水(D2O)中含有10NA个电子 | |
| B. | 22.4L一氯甲烷的分子数约为NA | |
| C. | 4.6g Na在氧气中完全反应生成Na2O和Na2O2,转移电子数为0.2NA | |
| D. | 25℃时,1L pH=14的Ba(OH)2溶液中,Ba2+数目为NA |
分析 A.根据重水的质量计算出物质的量及含有的电子数;
B.不一定在标况下;
C.根据钠的质量计算出物质的量,再根据电子守恒计算出转移的电子数;
D.根据溶液的pH及溶液的体积计算出氢氧根离子的物质的量及钡离子的物质的量和数目.
解答 解:A.20g重水的物质的量为1mol,含有10mol电子,含有10NA个电子,18g重水(D2O)中含有电子少于10NA,故A错误;
B.不一定在标况下,无法计算,故B错误;
C.4.6g钠的物质的量为0.2mol,完全反应失去0.2mol电子,转移电子数为0.2NA,故C正确;
D.25℃时,1L pH=14的Ba(OH)2溶液中,氢氧根离子的浓度为1mol/L,氢氧根离子的物质的量为1mol,含有钡离子的物质的量为0.5mol,Ba2+数为0.5NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数,注意标准状况下条件及物质的状态,注意电子守恒的应用,本题难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
19.下列有关氯气的说法中,错误的是( )
| A. | 氯气是有毒的气体 | |
| B. | 氯气可以与水反应生成有漂白作用的HClO | |
| C. | 氯气可以与氢氧化钠反应用于尾气的处理 | |
| D. | 实验室用加热分解KClO3的方法制取Cl2 |
3.下列离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| B. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O | |
| C. | Mg(HCO3)2溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ | |
| D. | 向含 0.5 mol的FeBr2溶液中通入13.44L(标准状况下)Cl2:10Fe2++14Br-+12Cl2=10Fe3++7Br2+24Cl- |
20.两个体积相同的容器,一只盛有HCl气体,另一个盛有H2和Cl2的混合气体,同温同压下两容器内的气体一定具有相同的( )
| A. | 质子总数 | B. | 原子总数 | C. | 分子总数 | D. | 质量 |
17.0.10mol/L的NaAlO2溶液中,离子浓度最小的是( )
| A. | Na+ | B. | H+ | C. | AlO2- | D. | OH- |

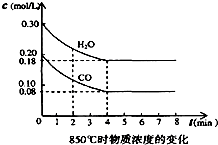 某可逆反应的平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,恒容时,温度升高H2浓度减小.试回答下列问题:
某可逆反应的平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,恒容时,温度升高H2浓度减小.试回答下列问题: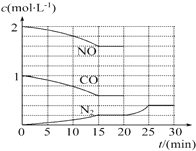 汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.
汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.