题目内容
6. A、B、C、D、E五种元素位于周期表的前四周期,原子序数依次增大.A元素可以形成-1价离子,B、D最外层电子数都是电子层数的2倍,C原子基态时2p轨道内未成对电子数最多,E原子位于周期表ds区,且d轨道中的电子数与最外层电子数之比为5:1.
A、B、C、D、E五种元素位于周期表的前四周期,原子序数依次增大.A元素可以形成-1价离子,B、D最外层电子数都是电子层数的2倍,C原子基态时2p轨道内未成对电子数最多,E原子位于周期表ds区,且d轨道中的电子数与最外层电子数之比为5:1.(1)C的价层电子排布式为2s22p3,CA3分子的空间构型为三角锥形;
(2)BC-与C2结构相似,推算由A、B、C形成的原子个数比为1:1:1的化合物中σ键与π键数目之比为1:1,该化合物中B原子轨道的杂化类型是sp,BC-的电子式为
 ;
;(3)A、B形成的某共价化合物与CA3分子电子数相等,后者在水中的溶解度远大于前者,原因是NH3可以与水分子形成氢键;
(4)D与E所形成化合物晶体的晶胞如图所示,晶胞棱长为anm.(已知该化合物摩尔质量为Mg/mol)
①在1个晶胞中,E离子的数目为4.
②该晶体的密度为=$\frac{4M×1{0}^{21}}{{a}^{3}{N}_{A}}$g/cm3.
分析 A、B、C、D、E五种元素位于周期表的前四周期,它们的原子序数依次增大.C原子基态时2p轨道内未成对电子数最多,核外电子排布为1s22s22p3,则C为N元素;A元素可以形成-1价离子,原子序数小于N元素,则A为H元素;B、D最外层电子数都是电子层数的2倍,B的原子序数小于N元素,D的原子序数大于N元素,则B处于第二周周期,D处于第三周期,B最外层电子数为4,D原子最外层电子数为6,则B为碳元素,D为S元素;E原子位于周期表ds区,且d轨道中的电子数与最外层电子数之比为5:1,则E为Zn,据此解答.
解答 解:A、B、C、D、E五种元素位于周期表的前四周期,它们的原子序数依次增大.C原子基态时2p轨道内未成对电子数最多,核外电子排布为1s22s22p3,则C为N元素;A元素可以形成-1价离子,原子序数小于N元素,则A为H元素;B、D最外层电子数都是电子层数的2倍,B的原子序数小于N元素,D的原子序数大于N元素,则B处于第二周周期,D处于第三周期,B最外层电子数为4,D原子最外层电子数为6,则B为碳元素,D为S元素;E原子位于周期表ds区,且d轨道中的电子数与最外层电子数之比为5:1,则E为Zn.
(1)C为N元素,核外电子排布为1s22s22p3,价层电子排布式为2s22p3,NH3分子的空间构型为 三角锥形,
故答案为:2s22p3;三角锥形;
(2)CN-与N2结构相似,则CN-与中C、N原子之间形成3对共用电子对,由A、B、C形成的原子个数比为1:1:1的化合物为HCN,结构式为H-C≡N,分子中σ键与π键数目之比为2:2=1:1,该化合物中碳原子原子轨道的杂化类型是sp杂化,CN-的电子式为 ,
,
故答案为:1:1;sp; ;
;
(3)A、B形成的某共价化合物CH4与NH3分子电子数相等,由NH3可以与水分子形成氢键,故氨气在水中的溶解度远大于甲烷,
故答案为:NH3可以与水分子形成氢键;
(4)D与E所形成化合物晶体的晶胞如图所示,晶胞棱长为anm.(已知该化合物摩尔质量为Mg/mol)
①在1个晶胞中,E离子的数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故答案为:4;
②在1个晶胞中,E离子的数目为4,D离子数目为4,故晶胞质量为$\frac{4×M}{{N}_{A}}$g,晶胞体积为(a×10-7cm)3,则该晶体的密度为$\frac{4×M}{{N}_{A}}$g÷(a×10-7cm)3=$\frac{4M×1{0}^{21}}{{a}^{3}{N}_{A}}$g/cm3,故答案为:$\frac{4M×1{0}^{21}}{{a}^{3}{N}_{A}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、分子构型、化学键、等电子体、杂化方式、电子式、氢键、晶胞计算等,注意对基础知识的理解掌握,难度中等.

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案| A. | Na+ | B. | H+ | C. | AlO2- | D. | OH- |
 阅读并分析下列两个材料.
阅读并分析下列两个材料.材料一:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇 (C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇 (C3H8O3) | 17.9 | 290 | 1.26 | 能跟水和乙醇 以任意比互溶 |
已知常见的物质分离的方法有:
A.蒸馏法;B.萃取法;C.“溶解、蒸发浓缩、冷却结晶、过滤”的方法;D.分液法.
根据上述材料及所学知识,回答下列问题:
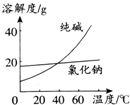
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好选用C(填序号,下同).
(2)将乙二醇和丙三醇相互分离的最佳方法是A.
(3)从溴水中提取溴单质的最佳方法是B或BD.
(4)分离汽油和水的最佳方法是D.
| A. | Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| B. | 向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2H++CO32-═BaCO3↓+2H2O | |
| C. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3 H+ | |
| D. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
| A. | 平衡向逆反应方向移动 | B. | a+b<c+d | ||
| C. | Y的体积分数减小 | D. | X的转化率下降 |
| 选项 | 反应 | 反应 |
| A | 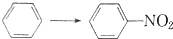 | CH2═CH2→CH3CH2Cl |
| B | CH3CH2Cl→CH3CH2OH | CH3CH2OH→CH3COOCH2CH3 |
| C | CH3CH2OH→CH2═CH2 | CH3CH2OH→CH3CHO |
| D | 油脂→甘油 |  |
| A. | A | B. | B | C. | C | D. | D |
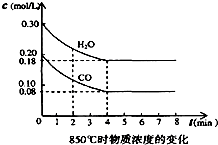 某可逆反应的平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,恒容时,温度升高H2浓度减小.试回答下列问题:
某可逆反应的平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,恒容时,温度升高H2浓度减小.试回答下列问题: