题目内容
13. 一定温度下体积为5L的密闭容器中发生可逆反应.
一定温度下体积为5L的密闭容器中发生可逆反应.一定温度下在体积为5L的密闭容器中发生可逆反应.
(Ⅰ)若某可逆反应的化学平衡常数表达式为:K=$\frac{c(CO)•c(H2)}{c({H}_{2}O)}$
(1)写出该反应的化学方程式:C(s)+H2O(g)?CO(g)+H2 (g);
(2)能判断该反应一定达到化学平衡状态的依据是A、B、C(填选项编号).
A.容器中气体的平均相对分子质量不随时间而变化
B.υ正(H2O)=υ逆(H2)
C.容器中气体的密度不随时间而变化
D.容器中总的物质的量不随时间而变化
E.消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1molH2O(g),t1秒时,H2的物质的量为0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol.
(1)t1~t2这段时间内的化学反应速率v(H2)=$\frac{0.03}{(t{\;}_{2}-t{\;}_{1})}$mol•L-1•s-1.
(2)若继续加入2mol Fe(s),则平衡不移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1mol H2O(g) 再次达到平衡后,H2的物质的量为0.7mol.
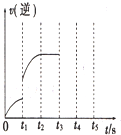
(3)该反应的逆反应速率随时间变化的关系如图.t1时改变了某种条件,改变的条件可能是使用了催化剂、升高了温度.(填写2项)
分析 (Ⅰ)(1)根据平衡常数的定义,即可写出发生反应的化学方程式;
(2)化学平衡的根本原因是正、逆反应速率相等,反应混合物中各组分的百分含量保持不变,然后根据具体的化学方程式,逐一判断.
(Ⅱ)(1)根据反应速率的计算公式,求v(H2)即可.
(2)加入Fe后,Fe是固体,平衡不移动;再加入1molH2O(g) 再次达到平衡够,H2的物质的量为原来的2倍.
(3)如右图t1时刻,反应速率突然增大,可能使用了催化剂等.
解答 解:(Ⅰ)(1)根据平衡常数的定义,生成物浓度的幂之积与反应物浓度的幂之积之比为平衡常数,所以该反应的化学方程式为C(s)+H2O(g)?CO(g)+H2 (g);
故答案为:C(s)+H2O(g)?CO(g)+H2 (g);
(2)A、反应前后气体的体积不相同,容器中气体的平均相对分子质量不断减小,当不随时间变化即达到平衡,故A正确;
B、υ正(H2O)=υ逆(H2)时,反应达到平衡,故B正确;
C、反应开始时,容器中气体的密度不断减小,当不随时间变化时,反应达到平衡,故C正确;
D、容器中总的物质的量自始至终不随时间而变化,故D错误;
E、消耗n mol H2的同时消耗n mol CO,反应都代表逆反应,故E错误;
故选A、B、C;
(Ⅱ)(1)根据反应速率的计算公式,v(H2)=$\frac{0.03}{(t{\;}_{2}-t{\;}_{1})}$mol•L-1•s-1.故答案为:$\frac{0.03}{(t{\;}_{2}-t{\;}_{1})}$mol•L-1•s-1
(2)加入Fe后,Fe是固体,平衡不移动;3Fe+4H2O=Fe3O4+4H2,K=$\frac{[H{\;}_{2}]{\;}^{4}}{[H{\;}_{2}O]{\;}^{4}}$,再加入1molH2O(g),浓度增大一倍,再次达到平衡,化学平衡常数不变,则H2的物质的量为原来的2倍,所以为0.35×2=0.7mol,故答案为:不;0.7;
(3)如右图t1时刻,反应速率突然增大,可能使用了催化剂、升高了温度、增大了H2的浓度等.
故答案为:使用了催化剂、升高了温度、增大了H2的浓度.
点评 本题是一道化学反应速率与平衡的综合题,考查了平衡常数的含义,化学平衡状态的判断标志,化学反应速率的计算,综合性强,难度较大.

| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| B. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O | |
| C. | Mg(HCO3)2溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ | |
| D. | 向含 0.5 mol的FeBr2溶液中通入13.44L(标准状况下)Cl2:10Fe2++14Br-+12Cl2=10Fe3++7Br2+24Cl- |
| A. | v(A)=0.02mol/(L•s) | B. | v(B)=0.03mol/(L•s) | ||
| C. | v(B)=0.90mol/(L•min) | D. | v(C)=0.60mol/(L•min) |
| A. | Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| B. | 向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2H++CO32-═BaCO3↓+2H2O | |
| C. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3 H+ | |
| D. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
| A. | 将锌反应完所需的时间相同 | B. | 起始时醋酸与锌反应的速率大 | ||
| C. | 醋酸与锌反应放出的氢气多 | D. | 两者放出的氢气一样多 |
| A. | 5 mL 0.6mol•L-1 Na2SO4溶液 | B. | 10 mL 0.3 mol•L-1 Na3PO4溶液 | ||
| C. | 5 mL 0.4 mol•L-1 NaOH溶液 | D. | 10mL 0.5 mol•L-1 NaNO3溶液 |
| A. | 该反应过程中体系的混乱度减小 | |
| B. | 由于△H>0,△S>0,可知该反应的条件为高温 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 在任何条件下△H-T△S都可作为化学反应方向的判据 |
 某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g);经过5min后,反应达到平衡,此时转移电子6mol.
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g);经过5min后,反应达到平衡,此时转移电子6mol.