题目内容
3.X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X的最外层电子数比内层电子数多1,Y是短周期元素中金属性最强的元素,Z的最外层电子数与次外层电子数之比为3:4.(1)Y的原子结构示意图为
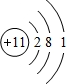 .
.(2)W的最高价氧化物对应水化物的化学式为HClO4,Y和W形成的化合物的电子式为

(3)隔绝空气加热,Y单质可与X的氧化物反应制备X单质,该反应的化学方程式为6Na+B2O3$\frac{\underline{\;\;△\;\;}}{\;}$2B+3Na2O
(4)0.2mol化合物Z2W2与水反应转移电子的物质的量为0.3mol,生成一种能使品红溶液褪色的气体,该反应过程中只有一种元素化合价发生变化,该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
分析 X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X的最外层电子数比内层电子数多1,原子只能有2个电子层,最外层电子数为3,故X为B元素;Y是短周期元素中金属性最强的元素,则Y为Na;Z的最外层电子数与次外层电子数之比为3:4,则Z为S元素,W原子序数最大,故W为Cl,据此解答.
解答 解:X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X的最外层电子数比内层电子数多1,原子只能有2个电子层,最外层电子数为3,故X为B元素;Y是短周期元素中金属性最强的元素,则Y为Na;Z的最外层电子数与次外层电子数之比为3:4,则Z为S元素,W原子序数最大,故W为Cl.
(1)Y为Na元素,原子结构示意图为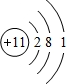 ,故答案为:
,故答案为: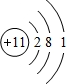 ;
;
(2)W为Cl元素,最高价氧化物对应水化物的化学式为HClO4,Y和W形成的化合物为NaCl,电子式为 ,故答案为:HClO4;
,故答案为:HClO4; ;
;
(3)隔绝空气加热,Na单质可与X的氧化物B2O3反应制备B单质,该反应的化学方程式为:6Na+B2O3$\frac{\underline{\;\;△\;\;}}{\;}$2B+3Na2O,故答案为:6Na+B2O3$\frac{\underline{\;\;△\;\;}}{\;}$2B+3Na2O;
(4)S2Cl2与水反应生成一种能使品红溶液褪色的气体为二氧化硫,只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl,故答案为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重考查学生运用知识分析问题、解决问题的能力,难度中等.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案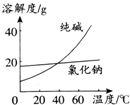 阅读并分析下列两个材料.
阅读并分析下列两个材料.材料一:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇 (C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇 (C3H8O3) | 17.9 | 290 | 1.26 | 能跟水和乙醇 以任意比互溶 |
已知常见的物质分离的方法有:
A.蒸馏法;B.萃取法;C.“溶解、蒸发浓缩、冷却结晶、过滤”的方法;D.分液法.
根据上述材料及所学知识,回答下列问题:
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好选用C(填序号,下同).
(2)将乙二醇和丙三醇相互分离的最佳方法是A.
(3)从溴水中提取溴单质的最佳方法是B或BD.
(4)分离汽油和水的最佳方法是D.
| A. | 平衡向逆反应方向移动 | B. | a+b<c+d | ||
| C. | Y的体积分数减小 | D. | X的转化率下降 |
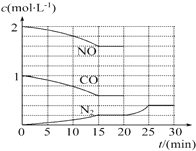 汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.
汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”. 【实验化学】
【实验化学】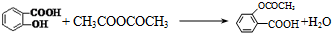
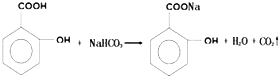 .
.