题目内容
【题目】某学生欲探究FeSO4溶液与浓HNO3的反应。
该同学向盛有FeSO4溶液的试管中滴入数滴浓硝酸,并振荡试管,预期现象为试管中会立即产生红棕色气体,溶液焰色逐渐变黄。但实际操作时观察到液面上方气体变化红棕色,且试管中溶液颜色变为深棕色。
为了进一步探究溶液变为深棕色的原因,该同学进行如下实验。
回答下列问题
(1)向FeSO4溶液和反应后溶液中加入KSCN溶液,前者不变红色,后者变红,该现象的结论是________。
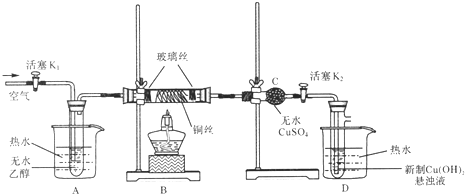
(2)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装备略)进行探究。

Ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
Ⅲ.为与Ⅰ中实验进行对照重新更换丙、丁后,使甲中反应重复进行步骤Ⅰ实验,观察到的现象与步骤Ⅰ中相同。
①铜与足量浓硝酸反应的离子方程式是_______________。
②装置乙的试剂为____________________。
③步骤Ⅱ的目的是_______________________。
④该实验可得出的结论是______________________。
(3)该同学重新进行FeSO4溶液与浓HNO3的反应的实验,观察到了预期现象,其实验操作是_________,反应的离子方程式为___________________
【答案】 原溶液中不含Fe3+,反应后溶液中含有Fe3+ Cu+4H++2NO3-=Cu2++2NO2+2H2O 水 排除乙右侧装置中的残留的NO2 NO、NO2可以与Fe2+水溶液作用产生深棕色,但Fe3+不行 向盛有浓硝酸的试管中,滴入数滴新制FeSO4溶液 Fe2++2H++NO3-=Fe3++NO2+H2O
【解析】(1)向原新制FeSO4溶液中和反应后溶液中均加入KSCN溶液,前者不变红色,后者变红,而由于Fe3+遇KSCN溶液显血红色,故可以说明原溶液中不含Fe3+,反应后溶液中含有Fe3+;
(2)①铜和浓硝酸反应的方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;②打开活塞b、关闭a,乙中需盛装水溶液,使NO2与水反应生成NO,来验证NO与溶液中Fe2+或Fe3+发生的反应:③装置乙有残留的NO2,所以需要反应一段时间后,利用生成的NO来排出装置中的NO2,从而可以获得纯净的NO;④打开活塞a,关闭b时,反应生成的NO2气体通入了FeSO4溶液中后显深棕色,而通入Fe2(SO4)3溶液中无现象;为与Ⅰ中实验进行对照,更换丙,丁后,使甲中反应继续,观察到的现象与步骤Ⅰ中相同,即NO通入FeSO4溶液后显深棕色,而通入Fe2(SO4)3溶液中无现象,因此实验结论是NO、NO2可以与Fe2+水溶液作用产生深棕色,但Fe3+不行;(3)由于实验I的现象是NO2气体通入了FeSO4溶液中后显深棕色,而通入Fe2(SO4)3溶液中无现象,故可以向盛有浓硝酸的试管中滴入数滴新制的FeSO4溶液,震荡,浓硝酸被还原为NO2,Fe2+被氧化为Fe3+,此时溶液应该无明显的颜色变化,反应的方程式为 Fe2++2H++NO3-=Fe3++NO2+H2O。

 阅读快车系列答案
阅读快车系列答案