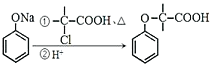
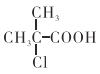题目内容
【题目】已知可分别通过如下两个反应制取氢气: ( )
a.CH3CH2OH(g)+H2O(g) ![]() 4H2(g)+2CO(g) ΔH=+256.6 kJ·mol-1
4H2(g)+2CO(g) ΔH=+256.6 kJ·mol-1
b.2CH3CH2OH(g)+O2(g) ![]() 6H2(g)+4CO(g) ΔH=+27.6 kJ·mol-1
6H2(g)+4CO(g) ΔH=+27.6 kJ·mol-1
则下列说法正确的是( )
A.乙醇的燃烧热ΔH=-13.8 kJ·mol-1
B.升高反应a的反应温度,乙醇的转化率减小
C.2H2(g)+O2(g)=2H2O(g) ΔH=-229 kJ·mol-1
D.制取等量的氢气,反应b吸收的能量更少
【答案】D
【解析】
A. 燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,乙醇的燃烧热应该是1mol乙醇生成二氧化碳和液态水放出的能量,故A错误;
B. 反应a吸热,升高a的反应温度,平衡正向移动,乙醇的转化率增大,故B错误;
C. 根据盖斯定律b-2a得:2H2(g)+O2(g)=2H2O(g)ΔH=-485.6 kJ·mol-1,故C错误;
D. 根据热化学方程式,制取等量的氢气,途径a消耗的能量更多,反应b吸收的能量更少,故D正确;
正确答案是D。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目