题目内容
【题目】根据下式表示的氧化还原反应设计一个原电池:Zn(s) + Fe2+(aq) == Zn2+(aq) + Fe(s)
(1)装置采用烧杯和盐桥,画出此原电池装置的简图:____________
(2)注明外电路的电子流向____________
(3)写出2个电极上的电极反应_____________、_________________
【答案】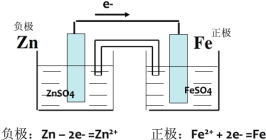 从负极流向正极,从锌流向铁 Zn-2e-=Zn2+ Fe2++2e-=Fe
从负极流向正极,从锌流向铁 Zn-2e-=Zn2+ Fe2++2e-=Fe
【解析】
根据电池反应式知,该反应中锌失电子发生氧化反应而作负极,因为有盐桥,正极可以是铁,锌电极对应的溶液为可溶性的锌盐溶液,一般用硫酸锌溶液,铁电极对应的溶液为可溶性的亚铁盐溶液,一般用硫酸亚铁溶液。
(1)由分析知装置图为:
 ,
,
(2)外电路中,电子从负极流向正极,从锌流向铁;
(3)负极上锌发生氧化反应,电极反应式为:Zn-2e-=Zn2+,正极电极反应式为:Fe2++2e-=Fe。

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)