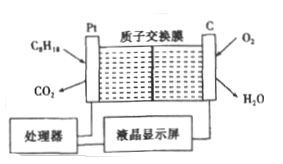
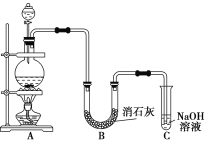
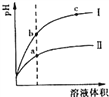
题目内容
【题目】实验室用MnO2和浓盐酸制氯气的反应为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑。反应中,如果有17.4 g纯MnO2被还原,那么:
MnCl2+2H2O+Cl2↑。反应中,如果有17.4 g纯MnO2被还原,那么:
(1)被氧化的氯化氢的质量为________________________________________________。
(2)转移电子的物质的量为________________________________________________。
(3)纺织工业中常用氯气作漂白剂,漂白布匹后,过量的氯需要除去,通常可用Na2SO3作“脱氯剂”,脱氯后的产物为Na2SO4,氯变为-1价。若把本题中产生的Cl2完全转化,需要Na2SO3的质量为_________。
【答案】14.6 g 0.4 mol 25.2 g
【解析】
(1)消耗二氧化锰的物质的量是17.4g÷87g/mol=0.2mol,则根据方程式可知
MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑ 被氧化HCl
MnCl2+2H2O+Cl2↑ 被氧化HCl
1mol 2mol
0.2mol 0.4mol
所以被氧化的氯化氢的质量为0.4mol×36.5g/mol=14.6g;
(2)反应中氯元素化合价从-1价升高到0价,失去1个电子,这说明每氧化1mol氯化氢转移1mol电子,所以转移电子的物质的量为0.4mol;
(3)被氧化的氯化氢的物质的量是0.4mol,生成氯气是0.2mol。氯气与亚硫酸钠反应生成硫酸钠和氯化钠,反应中亚硫酸钠中的S化合价升高,氯气中Cl化合价降低,设需要Na2SO3的物质的量是x,根据电子守恒可知x×(6-4)=0.2mol×2×(1-0),解得x=0.2mol,因此需要Na2SO3的质量是0.2mol×126g/mol=25.2g。

练习册系列答案
相关题目