题目内容
【题目】t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12。
(1)该温度下,水的离子积常数Kw=________________。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=_________,此时该溶液中由水电离的c(OH-)=____________。
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是______________。
【答案】 1×10-12 11 1×10-11mol/L a+b=14(或pH1+pH2=14)
【解析】本题主要考查有关水的离子积常数的计算。
(1)该温度下,水的离子积常数Kw=c(H+)c(OH-)=10-(a+b)=10-12。
(2)稀硫酸中c(H+)=0.2mol/L,NaOH溶液中c(OH-)=0.4mol/L,混合溶液中c(OH-)=(0.4-0.2)/2mol/L=0.1mol/L,c(H+)= 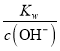 =
=![]() -mol/L=1×10-11mol/L,pH=11,此时该溶液中由水电离的c(OH-)=溶液中c(H+)=1×10-11mol/L。
-mol/L=1×10-11mol/L,pH=11,此时该溶液中由水电离的c(OH-)=溶液中c(H+)=1×10-11mol/L。
(3)该强酸溶液中c1(H+)=10-amol/L,该强碱溶液中c2(H+)=10-bmol/L,c(OH-)=10-(12-b)mol/L,混合后溶液呈中性,则100c1(H+)=10-a+2mol/L=c(OH-)=10-(12-b)mol/L,a+b=14,pH1=a,pH2=b,因此,pH1+pH2=14。

【题目】某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示. 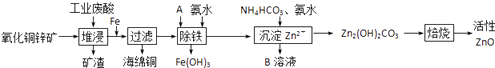
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”).
(2)物质A可使用下列物质中的 .
A.KMnO4
B.O2
C.H2O2
D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在范围之间.
(4)物质B可直接用作氮肥,则B的化学式是 .
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂﹣﹣K2FeO4 , 写出该反应的离子方程式 .