��Ŀ����
4����ĸA-F�������ֲ�ͬ���ʣ�����֮��ɷ�������ͼ��ת�������ַ�Ӧ��������û��ȫ���г���������D��һ��ǿ�E��һ�ֳ����������С�����������������������CO2��ȼ�գ�������ͼʾ�ش��������⣺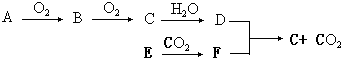
��1��A������N2��NH3��
��2��E��CO2��ȼ�յĻ�ѧ����ʽΪ2Mg+CO2$\frac{\underline{\;��ȼ\;}}{\;}$2MgO+C��
��3��D��F��Ӧ�Ļ�ѧ����ʽΪC+4HNO3$\frac{\underline{\;\;��\;\;}}{\;}$CO2��+2NO2��+2H2O���÷�Ӧ��D�����������ԣ�
��4��50mL 14mol•L-1����D����Һ�м���������ͭ����ַ�Ӧ���ռ�������2.24L����״���£�����ԭ��D�����ʵ���Ϊ0.3mol���μӷ�Ӧ��ͭ������Ϊ12.8g��
���� ����D��һ��ǿ�ᣬA��������Ӧ����B��B��������Ӧ����C��˵��BCΪ�����A�����Ƿǽ������ʣ�Ҳ�����Ƿǽ����⻯�E��һ�ֳ����������С��������������������ж�ΪMg������CO2��ȼ������MgO��C��F����D����������C�Ͷ�����̼����̼����ķ�Ӧ��Ũ�����Ũ���ᶼ���Է�Ӧ�������ɵIJ��Ǻ�����Ԫ�ػ��ϼ���ͬ������֤��DΪ���ᣬŨ������ϣ��ж�AΪN2��NH3��BΪNO��CΪNO2��DΪHNO3��EΪMg��FΪC��
��1������������֪DΪ���ᣬ��AΪ����������
��2��E��CO2��ȼ�յķ�ӦΪMg�Ͷ�����̼��Ӧ����̼������þ��
��3��D��F�ķ�Ӧ��̼��Ũ������ȵķ�Ӧ���ɶ�����̼������������ˮ���������ǿ�����ԣ�
��4�����������ͭ��Ӧ��ʼ���ɶ����������������һ��������
��� ����D��һ��ǿ�ᣬA��������Ӧ����B��B��������Ӧ����C��˵��BCΪ�����A�����Ƿǽ������ʣ�Ҳ�����Ƿǽ����⻯�E��һ�ֳ����������С��������������������ж�ΪMg������CO2��ȼ������MgO��C��F����D����������C�Ͷ�����̼����̼����ķ�Ӧ��Ũ�����Ũ���ᶼ���Է�Ӧ�������ɵIJ��Ǻ�����Ԫ�ػ��ϼ���ͬ������֤��DΪ���ᣬŨ������ϣ��ж�AΪN2��NH3��BΪNO��CΪNO2��DΪHNO3��EΪMg��FΪC��
��1������������֪DΪ���ᣬ��AΪ������������ѧʽΪ��N2��NH3��
�ʴ�Ϊ��N2��NH3��
��2��E��CO2��ȼ�յķ�ӦΪMg�Ͷ�����̼��Ӧ����̼������þ����Ӧ�Ļ�ѧ����ʽΪ��2Mg+CO2$\frac{\underline{\;��ȼ\;}}{\;}$2MgO+C��
�ʴ�Ϊ��2Mg+CO2$\frac{\underline{\;��ȼ\;}}{\;}$2MgO+C��
��3��D��F�ķ�Ӧ��̼��Ũ������ȵķ�Ӧ���ɶ�����̼������������ˮ���������ǿ�����ԣ���Ӧ�Ļ�ѧ����ʽΪ��C+4HNO3$\frac{\underline{\;\;��\;\;}}{\;}$CO2��+NO2��+2H2O����������������ԣ�
�ʴ�Ϊ��C+4HNO3$\frac{\underline{\;\;��\;\;}}{\;}$CO2��+NO2��+2H2O�������ԣ�
��4���������ʵ���=0.05L��14mol/L=0.7mol�����������ͭ��Ӧ��ʼ���ɶ���������������������ˮ��Ӧ����һ��������ֻ�ռ���NO�������ʵ���=$\frac{2.24L}{22.4L/mol}$=0.1mol��������Ӧ3NO2+H2O=2HNO3+NO���൱������NO2��0.3mol��ת�Ƶ���0.3mol������ԭ��HNO30.3mol���μӷ�Ӧ��Cu������=��0.7mol-0.3mol����64g/mol=12.8g��
�ʴ�Ϊ��0.3��12.8��
���� ���⿼���������ƶϺ��������ʵķ����жϣ���Ҫ�ǵ����仯�������ʵ�����Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | 60g�����д��ڵĹ��ۼ�����Ϊ10NA | |
| B�� | 1L 0.1mol•L-1��NaHCO3��Һ��HCO3-��CO32-������֮��Ϊ0.1NA | |
| C�� | ���ڿ�����ȼ�տ����ɶ��������23g�Ƴ��ȼ��ʱת�Ƶ�����Ϊ1NA | |
| D�� | 235g����92235U�����ѱ䷴Ӧ��92235U+01n$\stackrel{�ѱ�}{��}$3890Sr+54136Xe+1001n�����������ӣ�01n����Ϊ10NA |
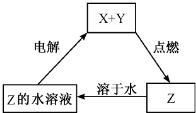
| A�� | X�����ǽ���ͭ | B�� | Y������������ | C�� | Z�������Ȼ��� | D�� | Z�������������� |
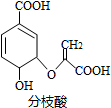
| A�� | �����к���2�ֹ����� | |
| B�� | �����Ҵ������ᷴӦ���ҷ�Ӧ������ͬ | |
| C�� | 1mol��֦��������3molNaOH�����кͷ�Ӧ | |
| D�� | ��ʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ����ԭ����ͬ |
| A�� | NaHSO4��Һ��Ba��OH��2��Һ��Ӧ | B�� | C6H5ONa��Һ��CO2��Ӧ | ||
| C�� | NaAlO2��Һ��CO2��Ӧ | D�� | Fe��ϡ���ᷴӦ |
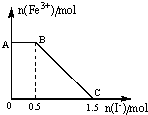 ��һ�����������ữ��KMnO4��Һ��FeSO4��Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ��Fe3+�����ʵ���������KI�����ʵ����ı仯��ϵ��ͼ��ʾ�������й�˵������ȷ���ǣ�������
��һ�����������ữ��KMnO4��Һ��FeSO4��Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ��Fe3+�����ʵ���������KI�����ʵ����ı仯��ϵ��ͼ��ʾ�������й�˵������ȷ���ǣ�������| A�� | ͼ��AB�η������ǹ���������KMnO4��Һ��KI�ķ�Ӧ | |
| B�� | �����п��Եó���ԭ�ԣ�I-��Fe2+��Mn2+ | |
| C�� | ȡB���Ժ��������Һ���뼸��KSCN��Һ����Һ���ɫ | |
| D�� | ����OC�ε����ݿ�֪����ʼ�����KMnO4�����ʵ���Ϊ0.5mol |
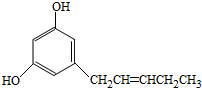
 ����ƽ���ͷ���
����ƽ���ͷ��� ��D�ĺ˴Ź�������ͼ�н�����4�ַ壻
��D�ĺ˴Ź�������ͼ�н�����4�ַ壻 ��
��
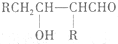 $\stackrel{��}{��}$
$\stackrel{��}{��}$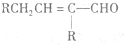 �ö���ȩ����Ҫ�ĺϳ����ϣ������ж��ص�����ˮ�������㣮�ɿ�����
�ö���ȩ����Ҫ�ĺϳ����ϣ������ж��ص�����ˮ�������㣮�ɿ�����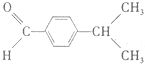 �ϳ��ö���ȩ��·�����£�
�ϳ��ö���ȩ��·�����£�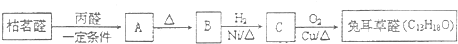
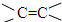 ��
��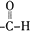 ��д�ṹʽ��������B�к��������ŵ�ʵ�鷽��������������Һ��ȡ����B���������Ƶ�������Һ�У�Ȼ��ˮԡ����
��д�ṹʽ��������B�к��������ŵ�ʵ�鷽��������������Һ��ȡ����B���������Ƶ�������Һ�У�Ȼ��ˮԡ����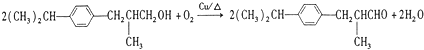 ��
��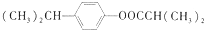 ��
��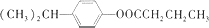 ��
��