题目内容
9.下列反应,改变反应物用量后仍能用同一个离子方程式表示的是 ( )| A. | NaHSO4溶液与Ba(OH)2溶液反应 | B. | C6H5ONa溶液与CO2反应 | ||
| C. | NaAlO2溶液与CO2反应 | D. | Fe与稀硝酸反应 |
分析 A.硫酸氢钠过量与不足时,反应的离子方程式不同;
B.苯酚的酸性大于碳酸氢根离子,则苯酚钠与二氧化碳反应生成苯酚和碳酸氢钠;
C.二氧化碳过量时,反应生成碳酸氢钠和氢氧化铝沉淀,二氧化碳步骤时生成碳酸钠;
D.铁与稀硝酸反应,当铁过量或不足时,反应产物不同.
解答 解:A.NaHSO4溶液与Ba(OH)2溶液反应,当硫酸氢钠不足时,离子方程式按照硫酸氢钠的化学式书写,其反应的离子方程式为:H++SO42-+Ba2++OH-=BaSO4↓+H2O;当硫酸氢钠过量时,离子方程式按照氢氧化钡的化学式组成书写,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,改变反应物的量后离子方程式不同,故A错误;
B.由于苯酚的酸性大于碳酸氢根离子,则苯酚钠与二氧化碳反应生成碳酸氢钠和苯酚,反应的离子方程式为:C6H5O-+CO2+H2O→C6H5OH+HCO3-,与反应物的量无关,故B正确;
C.当二氧化碳不足时,反应生成氢氧化铝沉淀和碳酸钠,反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,当二氧化碳过量时,反应生成氢氧化铝沉淀和碳酸氢钠,反应为:AlO2-+CO2+2H2O→Al(OH)3↓+HCO3-,反应产物与二氧化碳的过量情况有关,故C错误;
D.过量的铁与稀硝酸反应生成硝酸亚铁:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,若铁不足时生成硝酸铁:Fe+4H++NO3-═Fe3++NO↑+2H2O,铁的过量情况影响反应产物及离子方程式,故D错误;
故选B.
点评 本题考查了离子方程式书写判断,题目难度中等,明确离子方程式的书写原则及发生反应实质为解答关键,注意掌握反应物过量情况对生成产物的影响,试题培养了学生灵活应用基础知识的能力.

 名校课堂系列答案
名校课堂系列答案| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3•H2O调节pH=8可除去Fe3+(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{b({V}_{0}-{V}_{1})}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).
| A. | Na2S溶液中,2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| B. | 强碱弱酸盐NaA溶液的pH=8,则c(OH-)-c(HA)=1,0×10-8mol/L | |
| C. | KAl(SO4)2溶液中,c(SO42-)>c(K+)=c(Al3+)>c(H+)>c(OH-) | |
| D. | 向100ml pH=12 的 NaOH溶液中加入pH=2的醋酸溶液至中性,所得溶液的总体积大于200ml |
(1)锌-锰碱性电池广泛应用于日常生活.电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如图1:

①加入浓盐酸溶于废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如图2:
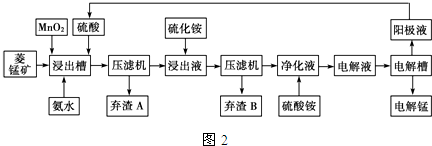
已知:NiS、CoS均难溶于水.部分氢氧化物的pH如表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
②加入氨水调节浸出槽中溶液的pH范围:3.8≤pH<8.3.
③弃渣B可能含有的物质为NiS、CoS.
④电解槽阴极的电极反应式为Mn2++2e-=Mn.
 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:Y>Z>X | |
| B. | 含Y元素的盐溶液有的显酸性,有的显碱性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | X与R的核电荷数相差24 |

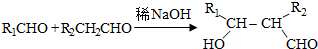
 .
. .
.
 (写结构简式)
(写结构简式)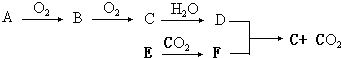

 .
.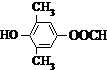 或
或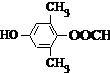 .
.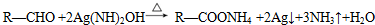 .
.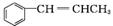 为原料制备
为原料制备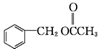 的合成路线流程图如下,试在方框内补充有机物的结构简式:
的合成路线流程图如下,试在方框内补充有机物的结构简式: