题目内容
15.分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( )
| A. | 分子中含有2种官能团 | |
| B. | 可与乙醇、乙酸反应,且反应类型相同 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
分析 由结构简式可知,分子中含-COOH、-OH、碳碳双键、醚键等,结合羧酸、醇、烯烃的性质来解答.
解答 解:A.分子中含-COOH、-OH、碳碳双键、醚键,共4种官能团,故A错误;
B.含-COOH与乙醇发生酯化反应,含-OH与乙酸发生酯化反应,故B正确;
C.不是苯环,只有-COOH与NaOH反应,则1mol分枝酸最多可与2molNaOH发生中和反应,故C错误;
D.碳碳双键与溴的四氯化碳溶液发生加成反应,双键与-OH均能被酸性高锰酸钾溶液氧化,原理不同,故D错误;
故选B.
点评 本题为2015年山东高考题,侧重有机物结构与性质的考查,把握官能团与性质的关系为解答的关键,注意官能团的判断,题目难度不大.

练习册系列答案
相关题目
5.用O2将HCl转化为Cl2,可提高效益,减少污染.

(1)传统上该转化通过如图1所示的催化循环实现.其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1,反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热用△H1和△H2表示).
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图2,则总反应的△H<0(填“>”、“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
③下列措施中,有利于提高αHCl的有BD.
A.增大n(HCl) B.增大n(O2)
C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol•min-1为单位,写出计算过程).
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.

(1)传统上该转化通过如图1所示的催化循环实现.其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1,反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热用△H1和△H2表示).
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图2,则总反应的△H<0(填“>”、“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
③下列措施中,有利于提高αHCl的有BD.
A.增大n(HCl) B.增大n(O2)
C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
6.中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( )
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 烧结粘土制陶瓷 | D. | 打磨磁石制指南针 |
3.下列说法不正确的是( )
| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
20.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3•H2O调节pH=8可除去Fe3+(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{b({V}_{0}-{V}_{1})}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3•H2O调节pH=8可除去Fe3+(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{b({V}_{0}-{V}_{1})}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).
2.下列反应的离子方程式正确的是( )
| A. | 二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ | |
| B. | 硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3•H2O+H2O | |
| C. | 碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3•H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |

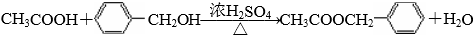 .
. .
. B.
B.
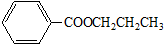
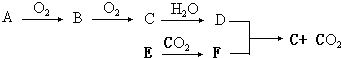

 .
. 或
或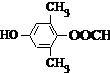 .
.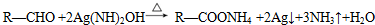 .
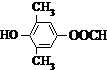
.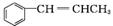 为原料制备
为原料制备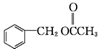 的合成路线流程图如下,试在方框内补充有机物的结构简式:
的合成路线流程图如下,试在方框内补充有机物的结构简式: