题目内容
13.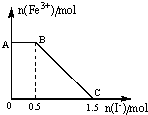 将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )
将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )| A. | 图中AB段发生的是过量的酸性KMnO4溶液与KI的反应 | |
| B. | 从题中可以得出还原性:I->Fe2+>Mn2+ | |
| C. | 取B点以后的少量溶液滴入几滴KSCN溶液,溶液变红色 | |
| D. | 根据OC段的数据可知,开始加入的KMnO4的物质的量为0.5mol |
分析 酸化的KMnO4溶液与FeSO4溶液混合后发生氧化还原反应,可知氧化性KMnO4>Fe3+;由图象可知,在反应后的溶液中滴加碘化钾溶液,开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为高锰酸钾和碘化钾的反应,BC段为铁离子和碘化钾的反应,结合得失电子守恒解答该题.
解答 解:A、酸化的KMnO4溶液与FeSO4溶液混合后发生氧化还原反应,可知氧化性KMnO4>Fe3+,当加入KI时,Fe3+的量开始一段时间不变,是因为I-还原了剩余的MnO4-,
故图中AB段发生的是过量的酸性KMnO4溶液与KI的反应,故A正确;
B、酸化的KMnO4溶液与FeSO4溶液混合后发生氧化还原反应,可知还原性Fe2+>Mn2+;当加入KI时,Fe3+的量开始一段时间不变,是因为I-还原了剩余的MnO4-为Mn2+,故还原性:I->Mn2+;然后Fe3+的物质的量不断减少,说明I-还原了Fe3+,说明还原性:I->Fe2+,故有:I->Fe2+>Mn2+,故B正确;
C、BC段为Fe3+与Fe2+的混合液,故加入KSCN溶液变红色,故C正确;
D、据电子守恒有MnO4-~~5I-,故剩余的KMnO4的物质的量为0.1mol,据电子守恒有MnO4-~~5Fe2+~~5Fe3+~~5I-,故与Fe2+的KMnO4的物质的量为0.2mol,故原来KMnO4的物质的量为0.3mol,故D错误.
故选D.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握反应的相关方程式的书写,根据方程式、关系式计算该题,难度中等.

练习册系列答案
相关题目
6.中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( )
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 烧结粘土制陶瓷 | D. | 打磨磁石制指南针 |
8.下列说法正确的是( )
| A. | pH=5的NH4Cl溶液或醋酸溶液中,由水电离出的c(H+)均为10-9mol•L-1 | |
| B. | 常温下,将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| C. | 在c(H+):c(OH-)=1:l012的溶液中,Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 0.1 mol•L-1 Na2CO3溶液和0.1 mol•L-1 NaHSO4溶液等体积混合,溶液中:c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
18.二氧化锰在生产、生活中有广泛应用.
(1)锌-锰碱性电池广泛应用于日常生活.电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如图1:
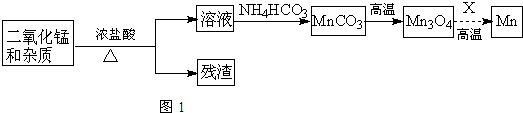
①加入浓盐酸溶于废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如图2:
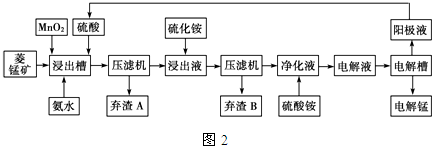
已知:NiS、CoS均难溶于水.部分氢氧化物的pH如表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
①用离子方程式表示加入二氧化锰的作用MnO2+4H++2Fe2+=2Fe3++Mn2++2H2O.
②加入氨水调节浸出槽中溶液的pH范围:3.8≤pH<8.3.
③弃渣B可能含有的物质为NiS、CoS.
④电解槽阴极的电极反应式为Mn2++2e-=Mn.
(1)锌-锰碱性电池广泛应用于日常生活.电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如图1:

①加入浓盐酸溶于废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如图2:

已知:NiS、CoS均难溶于水.部分氢氧化物的pH如表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
②加入氨水调节浸出槽中溶液的pH范围:3.8≤pH<8.3.
③弃渣B可能含有的物质为NiS、CoS.
④电解槽阴极的电极反应式为Mn2++2e-=Mn.
5.H、N、O、P、Cr、Fe是元素周期表中六种常见元素.
(1)P位于元素周期表第三周期第ⅤA族;Cr的基态原子价层电子排布式是3d54s1.O的一种18电子结构氢化物的电子式是 .
.
(2)用“>”“<”填空:
(3)以铁作阳极,利用电解生成的Fe2+而将酸性含铬废水(K2Cr2O7)中的铬元素还原为三价,之后电解沉淀而除去,写出前一步反应的离子方程式:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
(4)已知:
3Fe(s)+2O2(g)=Fe3O4(s)△H=-1118.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-438.6kJ/mol,
则3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)的△H=-151.2KJ/mol.
(1)P位于元素周期表第三周期第ⅤA族;Cr的基态原子价层电子排布式是3d54s1.O的一种18电子结构氢化物的电子式是
 .
.(2)用“>”“<”填空:
| 电负性 | 熔沸点 | 稳定性 | 酸性 |
| O>N | NH3>PH3 | Fe2+< Fe3+ | H3PO4<HNO3 |
(4)已知:
3Fe(s)+2O2(g)=Fe3O4(s)△H=-1118.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-438.6kJ/mol,
则3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)的△H=-151.2KJ/mol.
2.下列反应的离子方程式正确的是( )
| A. | 二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ | |
| B. | 硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3•H2O+H2O | |
| C. | 碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3•H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
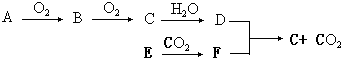
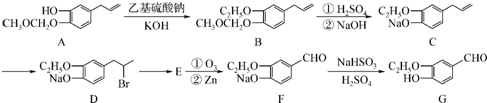
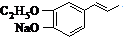 .
.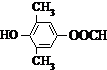 或
或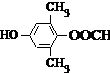 .
.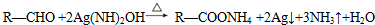 .
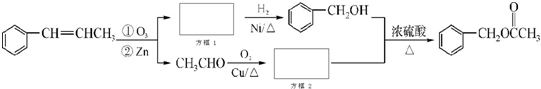
.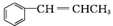 为原料制备
为原料制备 的合成路线流程图如下,试在方框内补充有机物的结构简式:
的合成路线流程图如下,试在方框内补充有机物的结构简式: