题目内容
7.在催化剂、400℃时可实现氯的循环利用,如图是其能量关系图,下列分析正确的是( )
| A. | 曲线a是使用了催化剂的能量变化曲线 | |
| B. | 反应物的总键能高于生成物的总键能 | |
| C. | 反应的热化学方程式为:4HCl(g)+O2(g)$→_{400℃}^{催化剂}$2Cl2+2H2O(g)-115.6 kJ | |
| D. | 若反应生成2mol液态水,放出的热量高于115.6kJ |
分析 A、催化剂改变反应速率,降低活化能;
B、依据反应物和生成物能量变化判断反应吸热放热,结合△H=反应物的总键能-生成物的总键能判断;
C、依据反应物和生成物能量变化判断反应吸热放热,据此书写热化学方程式;
D、依据气态水变成液态水还要放热判断.
解答 解:A、催化剂改变反应速率,降低活化能,所以曲线b是使用了催化剂,故A错误;
B、依据图象反应物的能量比生成物能量高,所以该反应为放热反应,又△H=反应物的总键能-生成物的总键能<0,则反应物的总键能小于生成物的总键能,故B错误;
C、依据图象反应物的能量比生成物能量高,所以该反应为放热反应,则反应的热化学方程式为:4HCl(g)+O2(g)$→_{400℃}^{催化剂}$2Cl2+2H2O(g)+115.6 kJ,故C错误;
D、由C反应的热化学方程式为:4HCl(g)+O2(g)$→_{400℃}^{催化剂}$2Cl2+2H2O(g)+115.6 kJ,又气态水变成液态水还要放热,所以若反应生成2mol液态水,放出的热量高于115.6 kJ,故D正确;
故选D.
点评 本题考查了热化学方程式书写及其键能与焓变之间的关系等,图象分析是关键,催化剂的作用分析是解题关键,题目难度中等.

练习册系列答案
相关题目
17.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
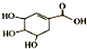

| A. | 分子式为C7H6O5 | B. | 可发生取代反应 | ||
| C. | 可使酸性高锰酸钾溶液褪色 | D. | 不能与溴水发生加成反应 |
2.化学与人类生活密切相关.下列说法正确的是( )
| A. | 矿物油和植物油都可以通过石油分馏来获取 | |
| B. | 硫酸亚铁可作补血剂组成成分 | |
| C. | 蛋白质的水解产物都是α-氨基酸 | |
| D. | 造成PM2.5的直接原因是土壤沙漠化 |
12.25℃时,NH3•H2O和CH3COOH的电离常数K相等.下列说法正确的是( )
| A. | 常温下,CH3COONH4溶液的pH=7,与纯水中H2O的电离程度相同 | |
| B. | 向CH3COONH4溶液加入CH3COONa固体时,c(NH4+)、c(CH3COO-)均会增大 | |
| C. | 常温下,等浓度的NH4Cl和CH3COONa两溶液的pH之和为14 | |
| D. | 等温等浓度的氨水和醋酸两溶液加水稀释到相同体积,溶液pH的变化值一定相同 |
13.分某学习小组在研究水处理问题时,将一定量NaClO溶液与FeSO4溶液相混合,得到含有大量悬浮物的混合液.请完成对反应物剩余情况的探究.
(1)提出合理假设:
假设1:FeSO4有剩余;
假设2:NaClO有剩余;
假设3:NaClO和FeSO4都无剩余
(2)样品初步处理:取少量混合液于试管中,滴加足量稀硫酸得到澄清溶液.此澄清溶液中肯定含有的金属阳离子是Na+,Fe3+
(3)设计后续实验方案验证假设.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol.L-1 H2SO4,0.01mol•L-1 KMnO4,20% KSCN、3% H2O2,淀粉-KI溶液、紫色石蕊溶液.
(1)提出合理假设:
假设1:FeSO4有剩余;
假设2:NaClO有剩余;
假设3:NaClO和FeSO4都无剩余
(2)样品初步处理:取少量混合液于试管中,滴加足量稀硫酸得到澄清溶液.此澄清溶液中肯定含有的金属阳离子是Na+,Fe3+
| 实验步骤 | 预期现象和结论 | |
| 步骤1 | 将上述澄清溶液分置于A、B试管中. | |
| 步骤2 | ||
| 步骤3 | ||
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题: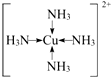 .
.