题目内容
7.下列是A、B、C、D、E五种元素的某些性质:| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
A.
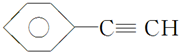 B.CH4
B.CH4C.CH2═CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键F-H…F、F-H…O、O-H…F、O-H…O.
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(化学式),理由是因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大.
(4)B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
分析 元素A是形成有机物的主要元素,且A元素能形成-4价,所以A是C元素,B和D能形成-2价,说明B、D位于第VIA族,且B的电负性小于D而大于A,B为S元素,D为O元素,C、E能形成-1价,说明C、E位于第VIIA族,C的电负性小于E,D的电负性小于E,则E为F元素,C为Cl元素,结合物质的结构、性质分析解答.
解答 解:元素A是形成有机物的主要元素,且A元素能形成-4价,所以A是C元素,B和D能形成-2价,说明B、D位于第VIA族,且B的电负性小于D而大于A,B为S元素,D为O元素,C、E能形成-1价,说明C、E位于第VIIA族,C的电负性小于E,D的电负性小于E,则E为F元素,C为Cl元素,
(1)分子中含有sp和sp3 杂化方式,说明分子中中心原子含有2个和4个价层电子对,
A.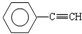 中苯环上碳原子含有3个价层电子对,碳碳三键上碳原子含有2个价层电子对,所以该分子中的碳原子采用SP2、SP杂化,故A错误;
中苯环上碳原子含有3个价层电子对,碳碳三键上碳原子含有2个价层电子对,所以该分子中的碳原子采用SP2、SP杂化,故A错误;
B.CH4分子中碳原子含有4个价层电子对,为sp3 杂化,故B错误;
C.CH2=CHCH3分子中,碳碳双键两端的碳原子含有3个价层电子对,为SP2杂化,甲基上碳原子含有4个价层电子对,为sp3杂化,故C错误;
D.CH3CH2C≡CH分子中,碳碳三键两端的碳原子含有2个价层电子对,为SP杂化,甲基和亚甲基上碳原子含有4个价层电子对,为sp3杂化,故D正确;
E.CH3CH3分子中甲基上碳原子含有4个价层电子对,为sp3杂化,故E错误;故选D;
(2)E的氢化物是氟化氢,氟化氢的水溶液中,氟化氢和氟化氢之间能形成氢键,水分子之间能形成氢键,水中氢离子和氟化氢中氟原子能形成氢键,氟化氢中氢原子和水中氧原子能形成氢键,所以其氢键有:F-H…F、F-H…O、O-H…F、O-H…O,故答案为:F-H…F、F-H…O、O-H…F、O-H…O;
(3)AD2与BD2分别是二氧化碳和二氧化硫,二氧化碳是非极性分子,二氧化硫是极性分子,根据相似相溶原理知,二氧化碳不如二氧化硫易溶于水,故答案为:SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大;
(4)水分子之间存在氢键,常温下水是液态,而硫化氢为气体,分子内无氢键,故水的沸点较高,元素的非金属性越强,其气态氢化物的热稳定性越高,即水的热稳定性大于硫化氢,故答案为:H2O;H2O.
点评 本题考查了化学式的确定、氢键、原子杂化方式的判断等知识点,这些都是考试热点,知道哪些物质之间能形成氢键、杂化方式的判断方法等即可解答,难度中等.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案(1)已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1
H2O(g)=H2O(l)△H2=-44kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol.
(2)若反应2H2(g)+O2(g)═2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据.则x=738.2 kJ•mol-1.
| 化学键 | H-H | O═O | O-H |
| 断开1mol化学键所需的能量/kJ | 436 | x | 463 |
①该温度下,在两个容积均为1L的密闭容器中,分别发生该反应:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO (g)和2mol H2(g) | 1mol CH3OH(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出54kJ | 吸收a kJ |
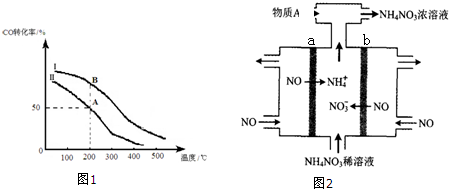
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线(图1)分别表示投料比不同时的反应过程. 若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,则:A点的平衡常数KA=0.01,B点的平衡常数KB=KA.(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是减小投料比,降低温度,增大压强,分离出CH3OH等(至少答出两条).
(4)电解NO制备NH4NO3,其工作原理如图2所示,则a电极名称为阴极,b电极反应式为NO+2H2O-3e-=NO3-+4H+.
| A. | 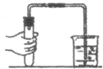 检查气密性 | B. |  稀释浓硫酸 | C. |  称取氯化钠 | D. |  过滤粗盐水 |
| A. | 常温下,0.1mol•L-1 Na2S溶液中存在:c(OH-)=c(H+ )+c(HS-)+c(H2S) | |
| B. | PH=3的醋酸溶液中:c(H+ )=c(CH3COO-)=0.3mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH- )=1×10-a mol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+ )>c(OH- ) |
| A. | 18gH20中含NA个质子 | |
| B. | 1L 1mol•L一1的CuSO4溶液中含NA个Cu2+ | |
| C. | 常温常压下,2.24L Cl2中含0.2NA个氯原子 | |
| D. | 0.5mol Al与足量NaOH溶液充分反应,转移的电子数目为1.5NA |
| A. | 乙醇 | B. | 丙醇 | C. | 乙二醇 | D. | 丙三醇 |
| A. | 1s22s1 | B. | 1s22s22p5 | ||
| C. | 1s22s22p63s2 | D. | 1s22s22p63s23p64s1 |
| A. | Na2O2既是氧化剂又是还原剂 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 3molNa2O2发生反应,有12mol电子转移 | |
| D. | Na2FeO4在水中被氧化得到Fe3+,Fe3+水解生成氢氧化铁,可净水 |
 实验室可用如图所示装置进行多个实验探究,请回答下列问题.
实验室可用如图所示装置进行多个实验探究,请回答下列问题.