题目内容
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 18gH20中含NA个质子 | |
| B. | 1L 1mol•L一1的CuSO4溶液中含NA个Cu2+ | |
| C. | 常温常压下,2.24L Cl2中含0.2NA个氯原子 | |
| D. | 0.5mol Al与足量NaOH溶液充分反应,转移的电子数目为1.5NA |
分析 A、求出水的物质的量,而1mol水含10mol质子;
B、Cu2+是弱碱阳离子,在溶液中会水解;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、根据反应后Al元素的价态为+3价来分析.
解答 解:A、18g水的物质的量n=$\frac{m}{M}$=$\frac{18g}{18g/mol}$=1mol,而1mol水含10mol质子,故A错误;
B、Cu2+是弱碱阳离子,在溶液中会水解,故溶液中Cu2+的个数小于NA个,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故2.24L氯气的物质的量小于0.1mol,故含有的氯原子的个数小于0.2NA个,故C错误;
D、反应后Al元素的价态为+3价,故1mol铝失去3mol电子,故0.5mol铝失去1.5mol电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 | |
| C. | 标准状况下,11.2LSO3所含分子数为0.5NA | |
| D. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
3.据报道,化学家创造出对CO2有较强吸收能力的粉末状物质--“干水”,其每个颗粒的外层是SiO2,内部含水95%.下列有关说法正确的是( )
| A. | 干水属于有机合成材料 | |
| B. | 干水中的水分子停止运动 | |
| C. | 干水是一种混合物 | |
| D. | 干水吸收CO2的过程只发生物理变化 |
7.下列是A、B、C、D、E五种元素的某些性质:
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是D.
A.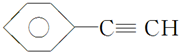 B.CH4
B.CH4
C.CH2═CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键F-H…F、F-H…O、O-H…F、O-H…O.
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(化学式),理由是因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大.
(4)B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
A.
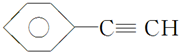 B.CH4
B.CH4C.CH2═CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键F-H…F、F-H…O、O-H…F、O-H…O.
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(化学式),理由是因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大.
(4)B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
1.X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是( )
| A. | R一定是共价化合物 | |
| B. | R一定是离子化合物 | |
| C. | R可能是共价化合物,也可能是离子化合物 | |
| D. | R是气态物质 |
2.下列化学用语正确的是( )
| A. | 8个质子10个中子的核素符号:10Ar | B. | H2O的电子式: | ||
| C. | 四氯化碳的电子式: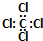 | D. | S2-离子的结构示意图: |

 .
.