题目内容
17.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知反应:Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是( )| A. | Na2O2既是氧化剂又是还原剂 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 3molNa2O2发生反应,有12mol电子转移 | |
| D. | Na2FeO4在水中被氧化得到Fe3+,Fe3+水解生成氢氧化铁,可净水 |
分析 Fe2O3+3Na2O2=2Na2FeO4+Na2O反应中,Fe元素化合价由+3价升高为+6价,过氧化钠中O元素化合价降低,以此来解答.
解答 解:A、反应中过氧化钠中 氧元素化合价选-1价降低到-2价,做氧化剂,故A错误;
B、Na2FeO4中的铁元素是从+3价变化来的成为+6价,氧元素化合价从-1价变化成-2价,所以Na2FeO4既是氧化产物又是还原产物,故B正确;
C、3 mol Na2O2发生反应,有6 mol电子转移,故C错误;
D、在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌,在水中被还原为Fe3+,Fe3+水解生成氢氧化铁,可净水,故D错误;
故选B.
点评 本题考查了氧化还原反应的应用,主要考查氧化还原反应的特征应用,概念分析,电子转移计算,氧化产物和还原产物的分析判断,题目难度不大.

练习册系列答案
相关题目
7.下列是A、B、C、D、E五种元素的某些性质:
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是D.
A.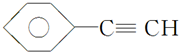 B.CH4
B.CH4
C.CH2═CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键F-H…F、F-H…O、O-H…F、O-H…O.
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(化学式),理由是因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大.
(4)B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
A.
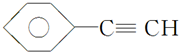 B.CH4
B.CH4C.CH2═CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键F-H…F、F-H…O、O-H…F、O-H…O.
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(化学式),理由是因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大.
(4)B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
8.有关下列图象的分析错误的是( )
| A. | 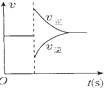 图可表示对平衡N2+3H2?2NH3加压、同时移除部分NH3时的速率变化 | |
| B. | 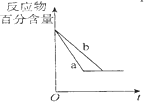 图中a、b曲线只可表示反应H2(g)十I2(g)?2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 | |
| C. | 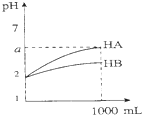 图表示室温下将各1 ml pH=2的HA、HB两种酸溶液加水稀释的情况.若2<a<5,则两酸都为弱酸 | |
| D. | 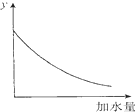 图中的y可表示将O.1 mol/l稀醋酸加水稀释时溶液导电能力的变化情况 |
5.任何科学真理的发现,都不是一帆风顺的,门捷列夫的元素周期表奠定了现代化学和物理学的理论基础.下列关于元素周期表的说法中,不正确的是( )
| A. | 周期表中的副族、Ⅷ族都是金属元素 | |
| B. | 周期表中的ⅡA族都是金属元素 | |
| C. | 周期表中的非金属元素都位于短周期 | |
| D. | 周期表中的0族元素都是非金属元素 |
2.下列化学用语正确的是( )
| A. | 8个质子10个中子的核素符号:10Ar | B. | H2O的电子式: | ||
| C. | 四氯化碳的电子式: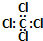 | D. | S2-离子的结构示意图: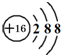 |


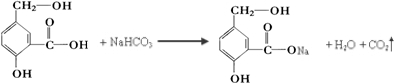
 .
. (塑料)、
(塑料)、 (橡胶).
(橡胶). 的单体为CH2=C(CH3)2、CH2=CH-CH=CH2、CH2=CHCH2CH3.
的单体为CH2=C(CH3)2、CH2=CH-CH=CH2、CH2=CHCH2CH3.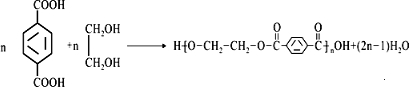 .
. 、
、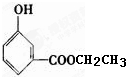 、
、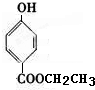 .
.