题目内容
2.下列有关说法正确的是( )| A. | 常温下,0.1mol•L-1 Na2S溶液中存在:c(OH-)=c(H+ )+c(HS-)+c(H2S) | |
| B. | PH=3的醋酸溶液中:c(H+ )=c(CH3COO-)=0.3mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH- )=1×10-a mol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+ )>c(OH- ) |
分析 A、根据质子守恒分析解答;
B、氢离子来源于醋酸和水的电离,由此分析解答;
C、25℃时,某溶液中水电离出的[H+]=1×10-amol•L-1,若a>7,水的电离受到抑制,可能是强酸或强碱溶液;
D、pH=12的氨水与pH=2的盐酸中,氨水浓度大于盐酸,等体积混合,氨水过量,溶液呈碱性.
解答 解:A、根据质子守恒,可知:c(OH-)=c(H+ )+c(HS-)+2c(H2S),故A错误;
B、氢离子来源于醋酸和水的电离,所以c(H+ )=0.3mol•L-1>c(CH3COO-),故B错误;
C、25℃时,某溶液中由水电离出的[H+]=1×10-amol•L-1,若a>7,水的电离程度减少,因为它们都会抑制水的电离,所以可能是强酸或强碱溶液,若是强酸,pH为14-a,.若是强碱,pH为a,故C正确;
D、pH=12的氨水与pH=2的盐酸中,氨水浓度大于盐酸,等体积混合,氨水过量,溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以得c(NH4+)>c(Cl-),溶液中一水合氨电离程度较小,所以c(Cl-)>c(OH-),则溶液中离子浓度大小顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了弱电解质的电离、酸碱混合溶液定性判断、盐的水解等知识点,根据酸碱混合溶液的酸碱性结合电荷守恒来分析解答,比较容易.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
12. 为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.
为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.
(1)已知:①CO(g)+H2O(g)═H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)═CH4(g)△H=-73kJ•mol-1
③2CO(g)═C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O的热化学方程式:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)利用合成气可制备新型燃料甲醇:CO(g)+2H2(g)?CH3OH(g)△H,下表所列数据是该反应在不同温度下的化学平衡常数(K).
①由表中数据可判断该反应的△H<0(填“>”、“=”或“<”).
②某温度下,将2mol CO和6mol H2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为2CH3OH+3O2+4OH-═2CO32-+6H2O.
 为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.
为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.(1)已知:①CO(g)+H2O(g)═H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)═CH4(g)△H=-73kJ•mol-1
③2CO(g)═C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O的热化学方程式:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)利用合成气可制备新型燃料甲醇:CO(g)+2H2(g)?CH3OH(g)△H,下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为2CH3OH+3O2+4OH-═2CO32-+6H2O.
13.人们能够闻到茶香的原因是( )
| A. | 分子之间有间隔 | B. | 分子在不断运动 | ||
| C. | 分子的质量和体积都很小 | D. | 分子由原子构成 |
7.下列是A、B、C、D、E五种元素的某些性质:
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是D.
A.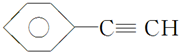 B.CH4
B.CH4
C.CH2═CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键F-H…F、F-H…O、O-H…F、O-H…O.
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(化学式),理由是因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大.
(4)B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
A.
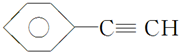 B.CH4
B.CH4C.CH2═CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键F-H…F、F-H…O、O-H…F、O-H…O.
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(化学式),理由是因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大.
(4)B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
14.分别向含有下列离子的溶液中通入足量NO2气体,数目不会减少的是( )
| A. | SO${\;}_{3}^{2-}$ | B. | CH3COO- | C. | Fe2+ | D. | Al3+ |
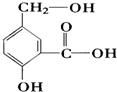

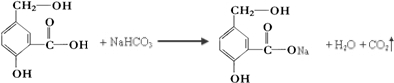
 .
.