题目内容
17.SO2、CO、NOx是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径.请回答下列问题:(1)已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1
H2O(g)=H2O(l)△H2=-44kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol.
(2)若反应2H2(g)+O2(g)═2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据.则x=738.2 kJ•mol-1.
| 化学键 | H-H | O═O | O-H |
| 断开1mol化学键所需的能量/kJ | 436 | x | 463 |
①该温度下,在两个容积均为1L的密闭容器中,分别发生该反应:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO (g)和2mol H2(g) | 1mol CH3OH(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出54kJ | 吸收a kJ |
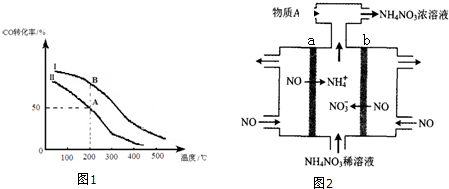
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线(图1)分别表示投料比不同时的反应过程. 若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,则:A点的平衡常数KA=0.01,B点的平衡常数KB=KA.(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是减小投料比,降低温度,增大压强,分离出CH3OH等(至少答出两条).
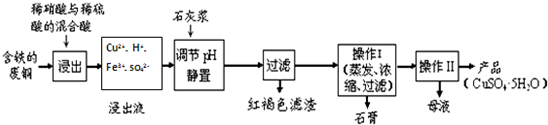
(4)电解NO制备NH4NO3,其工作原理如图2所示,则a电极名称为阴极,b电极反应式为NO+2H2O-3e-=NO3-+4H+.
分析 (1)根据盖斯定律,已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也进行相应的计算;
(2)反应热=反应物总键能-生成物总键能;
(3)①恒温恒容下,甲中起始投入1mol CO (g)和2mol H2(g),相当于起始投入1mol CH3OH(g),则甲与乙为完全等效平衡,平衡时对应各物质的浓度相等;
根据甲平衡时放出的热量,计算甲中平衡时生成CH3OH的物质的量,甲、乙为完全等效平衡,平衡时甲醇的物质的量相等,可以计算乙中参加反应甲醇的物质的量,结合反应热计算乙中吸收的热量;
②根据投料比计算起始投入氢气物质的量,由图可知,曲线Ⅱ上A点CO的转化率为50%,据此计算参加反应CO的物质的量,利用三段式计算平衡时各物质的物质的量,由于体积为1L,用物质的量代替浓度代入平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算;
平衡常数只受温度影响,温度相等,则平衡常数相等;
③为提高CO转化率,改变条件应使平衡向正反应方向移动,该反应正反应为气体体积减小的放热反应,结合平衡移动原理解答;
(3)由图可知,a极上NO生成NH4+,发生还原反应,为电解池阴极,b极上NO生成NO3-,发生氧化反应,由元素守恒有水参加反应,由电荷守恒可知有氢离子生成.
解答 解:(1)已知:①2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1
②H2O(g)=H2O(l)△H2=-44kJ•mol-1
③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ•mol-1
根据盖斯定律,(③-①)×$\frac{1}{2}$-②得:SO3(g)+H2O(l)═2H2S O4(l)△H=$\frac{1}{2}$×[(-545kJ/mol)-(-197kJ/mol)]-(-44kJ/mol)=-130 kJ/mol,
故反应热化学方程式为:SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol,
故答案为:SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol;
(2)由于反应热=反应物总键能-生成物总键能,则:2×436kJ/mol+xkJ/mol-4×463kJ/mol=-241.8kJ/mol,解得x=738.2,
故答案为:738.2;
(3)①恒温恒容下,甲中起始投入1mol CO (g)和2mol H2(g),相当于起始投入1mol CH3OH(g),则甲与乙为完全等效平衡,平衡时对应各物质的浓度相等,即c1=c2,
甲中放出热量为54kJ,则生成甲醇为1mol×$\frac{54kJ}{90kJ}$=0.6mol,甲、乙为完全等效平衡,平衡时甲醇的物质的量相等,乙中参加反应甲醇的物质的量为1mol-0.6mol=0.4mol,乙中吸收的热量为0.4mol×90kJ/mol=36kJ,
故答案为:=;36;
②若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,则起始投入氢气为20mol,由图可知,曲线Ⅱ上A点CO的转化率为50%,参加反应CO的物质的量为10mol×50%=5mol,则:
CO(g)+2H2(g)?CH3OH(g)
开始(mol):10 20 0
转化(mol):5 10 5
平衡(mol):5 10 5
由于体积为1L,用物质的量代替浓度计算,故平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{5}{5×1{0}^{2}}$=0.01,
平衡常数只受温度影响,与物质的起始浓度无关,A、B两点温度相等,故平衡常数KB=KA,
故答案为:0.01;=;
③为提高CO转化率,改变条件应使平衡向正反应方向移动,该反应正反应为气体体积减小的放热反应,可以采取的措施有:减小投料比,降低温度,增大压强,分离出CH3OH等,
故答案为:减小投料比,降低温度,增大压强,分离出CH3OH等;
(3)由图可知,a极上NO生成NH4+,发生还原反应,为电解池阴极,b极上NO生成NO3-,发生氧化反应,由元素守恒有水参加反应,由电荷守恒可知有氢离子生成,b极电极反应式为:NO+2H2O-3e-=NO3-+4H+,
故答案为:阴极;NO+2H2O-3e-=NO3-+4H+.
点评 本题属于拼合型题目,涉及热化学方程式书写、反应热计算、化学平衡有关计算及影响因素、电解池等,侧重考查学生对知识的迁移应用,(3)中①注意形成规律:从正、逆两个过程形成的完全等效平衡,反应的热量之和等于反应热数值的绝对值.

 名校课堂系列答案
名校课堂系列答案(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
①红褐色滤渣的主要成分是Fe(OH)3;
②写出浸出过程中生成硝酸铜的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作II应为将热溶液冷却结晶、过滤、洗涤、干燥.
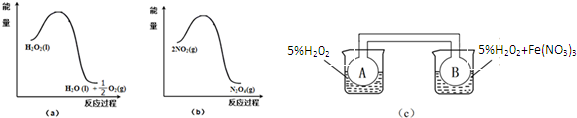
(2)某兴趣小组在实验室利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行Fe(NO3)3对H2O2分解速率影响的实验.5min后可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是Fe(NO3)3在H2O2分解反应中起催化作用.从图a知H2O2的分解反应为放热反应,从图b也知2NO2?N2O4反应为放热反应,B瓶中H2O2在Fe(NO3)3催化剂的作用下分解快,相同时间内放热多,因此B瓶所处温度高,2NO2?N2O4平衡逆向移动,NO2浓度大,颜色深.
| A. | 第四周期IVA族 | B. | 第五周期IVA族 | C. | 第四周期VA族 | D. | 第五周期VA族 |
 为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.
为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.(1)已知:①CO(g)+H2O(g)═H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)═CH4(g)△H=-73kJ•mol-1
③2CO(g)═C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O的热化学方程式:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)利用合成气可制备新型燃料甲醇:CO(g)+2H2(g)?CH3OH(g)△H,下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
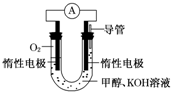
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为2CH3OH+3O2+4OH-═2CO32-+6H2O.
| A. | 1mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 | |
| C. | 标准状况下,11.2LSO3所含分子数为0.5NA | |
| D. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
| A. | 4.48L | B. | 5.6L | C. | 6.72L | D. | 13.44L |
| A. | N2 | B. | CO2 | C. | BF3 | D. | PCl3 |
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
A.
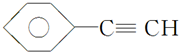 B.CH4
B.CH4C.CH2═CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键F-H…F、F-H…O、O-H…F、O-H…O.
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(化学式),理由是因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大.
(4)B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
 有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.
有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.