题目内容
【题目】I.硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。

已知:溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨饱和溶液中c(OH-)约为1×10-3 mol·L-1。
(1)写出A与氢氧化钠溶液反应的化学方程式:______________。
(2)上述流程中两次使用试剂①,推测试剂①应该是________ (填字母)。
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)H中溶质是________。
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是_______的化学式
(5)计算溶液F中的c(Mg2+)=___________________(25 ℃时,氢氧化镁的Ksp=5.6×10-12)。
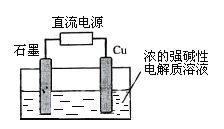
II.某化学兴趣小组用下图所示装置进行电化学原理的实验探究.
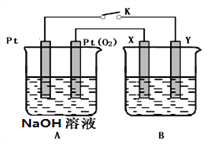
(1)A装置为乙醇燃料电池,若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为___________。
(2)若B电池的电解质溶液为500 mL 1.0mol/L的NaCl溶液,X、Y皆为惰性电极,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时B电池溶液的pH=_______,要使该溶液恢复到原来的状态,需加入___________(填物质并注明物质的量)。
【答案】 SiO2+2NaOH = Na2SiO3 + H2O A NaHCO3 AI3+不能完全变为偏铝酸根 5.6×10-10 2Cu-2e-+2OH-=Cu2O + H2O 13 0.05mol HCI
【解析】I.(1)硫酸渣中只有SiO2不与盐酸反应,但能够和强碱反应生成硅酸钠和水,反应的化学方程式:SiO2+2NaOH = Na2SiO3 + H2O ;正确答案:SiO2+2NaOH = Na2SiO3 + H2O。
(2)加入试剂①的目的要调节溶液的pH,加入的试剂既能与酸反应,同时溶液的pH能够调整到pH=13,只能用氢氧化钠溶液才能达到,一水合氨饱和溶液中c(OH-)约为1×10-3 pH=11,达不到pH=13;氧化铝不能调整溶液到碱性, 正确选项A。
(3)F溶液中含有偏铝酸根离子,通入足量的二氧化碳气体,生成氢氧化铝和碳酸氢钠,所以H中溶质是NaHCO3,正确答案:NaHCO3。
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,导致铝离子不能完全转化为偏铝酸根离子,正确答案:AI3+不能完全变为偏铝酸根。
(5)pH=13,c(OH-)=0.1mol/L,Ksp=c(Mg2+)×c2(OH-)=5.6×10-12,c(Mg2+)= 5.6×10-10 mol/L,正确答案:5.6×10-10。
II.(1)通过题给信息可知,X、Y均是铜,但X极附近生成砖红色沉淀,说明该极发生了氧化反应,铜在碱性环境下失电子变为Cu2O,极反应为2Cu-2e-+2OH-=Cu2O + H2O;正确答案:2Cu-2e-+2OH-=Cu2O + H2O。
(2)X、Y皆为惰性电极,电解NaCl溶液,总反应为2NaCl+2H2O=2NaOH+Cl2↑+H2↑, Y电极产生氢气560mL(即0.025 mol),根据方程式可知生成NaOH的量为0.05 mol,NaOH溶液的浓度为0.05/0.5=0.1mol/L,c(H+)=10-13 mol/L,B电池溶液的pH=13;电解完成后,从溶液中溢出了氢气和氯气各0.025 mol,要使该溶液恢复到原来的状态,需加入氯化氢气体0.05 mol;正确答案:0.05mol HCI。

【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
【题目】向2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g) ![]() D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T ℃时,该反应的平衡常数K=____________________________。
(2)30 min后,只改变某一条件,反应重新达到平衡,据表中数据判断改变的条件可能是_____(填编号)。
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2 mol B、0.1 mol D、0.1 mol E
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为下图中的____________(填序号)。
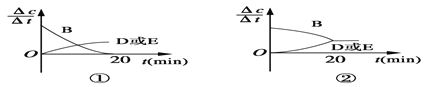
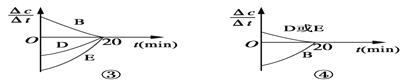
(4)容器的体积和温度T1 ℃不变,向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和n mol A,达到平衡后,与表格中20分钟时各物质的浓度完全相同,投入固体A的物质的量n的取值范围是______。
(5)若该密闭容器绝热,实验测得B的转化率随温度变化的示意图如图所示。由图可知,Q________0(填“大于”或“小于”),c点v正________v逆(填“大于”、“小于”或“等于”)。