题目内容
【题目】铅酸蓄电池是常见的化学电源,其电极材料分别是Pb和PbO2,电解质溶液为一定浓度的硫酸。充放电的总反应是: Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O

(1)该蓄电池放电工作时电解质溶液中SO42-移向________(填“正极”或“负极”,下同)充电时,该极接直流电源的_________。
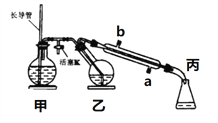
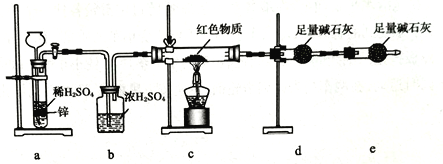
(2)Cu2O是一种半导体材料,可通过右图的电解装置制取,电解总反应为:2Cu+H2O![]() Cu2O+H2↑
Cu2O+H2↑
阴极的电极反应式是__________________________。 若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时,Cu2O的理论产量为_______g。
(3)为防止钢闸门在水中被腐蚀,可将其与铅酸蓄电池的_______极相连(填Pb或PbO2)。
(4)用铅蓄电池电解500mL饱和食盐水(足量)。电解一段时间后,共收集到气体1120mL(已折算成标准状况下),则所得溶液的pH=_________(不考虑气体的溶解及电解前后溶液体积的变化)
【答案】 负极 负极 2H++2e-=H2↑ 7.2 Pb 13
【解析】(1)放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,故SO42-移向负极;充电时,该极接直流电源的负极;(2)在电解池中,阴极是阳离子氢离子发生得电子得还原反应,即2H++2e-=H2↑;根据电子守恒,当蓄电池中有0.2mol H+被消耗时,转移电子是0.2mol,当转移0.2mol电子时,根据电解反应:2Cu+H2O![]() Cu2O+H2↑,Cu2O的生成量为0.05mol,质量为7.2g;(3)为防止钢闸门在水中被腐蚀,利用外加电源的阴极保护法,则可将其与铅酸蓄电池的负极Pb极相连;(4)根据电极反应方程式
Cu2O+H2↑,Cu2O的生成量为0.05mol,质量为7.2g;(3)为防止钢闸门在水中被腐蚀,利用外加电源的阴极保护法,则可将其与铅酸蓄电池的负极Pb极相连;(4)根据电极反应方程式![]() 可知,电解一段时间后,共收集到标准状况下气体1120mL,则所得溶液的n(OH-)=
可知,电解一段时间后,共收集到标准状况下气体1120mL,则所得溶液的n(OH-)=![]() ,c(OH-)=
,c(OH-)= ![]() ,pH=13。
,pH=13。

【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×102 Ka2=6.2×108 |
(1)25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,3种溶液的pH由大到小的顺序为____________________________________________。
(2)工业上可用氨水除去尾气SO2。
①若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=________mol·L1。向该氨水中加入少量NH4Cl固体,溶液的pH__________(填“升高”或“降低”);若加入少量明矾,溶液中NH![]() 的浓度____________(填“增大”或“减小”)。
的浓度____________(填“增大”或“减小”)。
②将SO2通入氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_________________。
)=_________________。
(3)若某溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)____________c(OH-)。
(4)根据表中所给的信息,向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为____________________________________________________