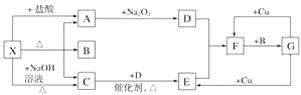
��Ŀ����
����Ŀ���úڱ���(��Ҫ�ɷ�ΪBaS)�����̿�(��Ҫ�ɷ�ΪMnO2)Ϊԭ����ȡBa(OH)2��8H2O��MnCO3�Ĺ����������£�
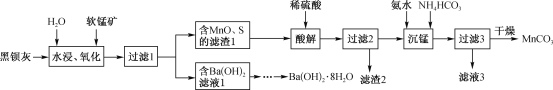
�ش��������⣺
(l)��ˮ����������ʱ��BaS��ת��ΪBa(OH)HS��Һ��MnO2������Ba(OH)HS��д���ڶ�����Ӧ�Ļ�ѧ����ʽ��_________________________��
(2)����1������Ba(OH)2��Һ���Ƶ�Ba(OH)2��8H2O�����辭���ľ���ʵ�������_________��������õ�Ba(OH)2��8H2O��Ʒ[��֪Ba(OH)2��20�桢60�桢80��ʱ�ܽ������Ϊ:3.76g��17.65g��101.4g]��
(3)������2������Ҫ�ɷ�Ϊ_______(�ѧʽ)����������ʱ������Ӧ�����ӷ���ʽΪ________������Һ3���пɻ��յIJ�ƷΪ__________(�ѧʽ)��
���𰸡�MnO2+Ba(OH)HS=MnO+S+ Ba(OH)2 ����Ũ������ȴ�ᾧ�����ˡ�ϴ�� S Mn2++ NH3��H2O+HCO3-=MnCO3��+NH4++H2O (NH4)2SO4
��������
(l)��ˮ����������ʱ��BaS��ת��ΪBa(OH)HS��Һ��MnO2������Ba(OH)HS��������ͼ��֪����Ӧ����ΪMnO��S�ȣ��ɴ˿�д���ڶ�����Ӧ�Ļ�ѧ����ʽ��
(2)����1������Ba(OH)2��Һ���Ƶ�Ba(OH)2��8H2O�����辭������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ�������õ�Ba(OH)2��8H2O��
(3)��ϡ�����ܽ�MnO��S ��MnO��ϡ���ᷴӦ����S����Ӧ���ɴ˱��ȷ��������2������Ҫ�ɷ֣���������ʱ�������백ˮ��̼����立�Ӧ������MnCO3������淋ȣ�Ҳ�͵ó�����Һ3���пɻ��յIJ�Ʒ��
(l)������ͼ��֪��MnO2����Ba(OH)HS������MnO��S�ȣ���Ӧ�Ļ�ѧ����ʽΪMnO2+Ba(OH)HS=MnO+S+ Ba(OH)2����Ϊ��MnO2+Ba(OH)HS=MnO+S+ Ba(OH)2��
(2)����Ba(OH)2��Һ���Ƶ�Ba(OH)2��8H2O��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ�������õ�Ba(OH)2��8H2O����Ϊ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ�
(3)��ϡ�����ܽ�MnO��S��MnO+H2SO4=MnSO4+H2O����S����Ӧ����������2������Ҫ�ɷ�ΪS����������ʱ��������Ӧ�Ļ�ѧ����ʽΪMnSO4+ NH3��H2O+NH4HCO3=MnCO3��+(NH4)2SO4+H2O�����ӷ���ʽΪMn2++ NH3��H2O+HCO3-=MnCO3��+NH4++H2O������Һ3���пɻ��յIJ�ƷΪ(NH4)2SO4����Ϊ��S��Mn2++ NH3��H2O+HCO3-=MnCO3��+NH4++H2O��(NH4)2SO4��