题目内容
【题目】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为__________,N、O、S元素的原子对键合电子吸引力最大的是___________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN中含有的π键的数目为__________。与CN互为等电子体的离子或分子有__________(写出一种即可)。
(3)[Cu(NH3)4]2+中,提供孤对电子的是___________。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是___________(填“极性”或“非极性”)分子,由此推知[Cu(NH)4]2+的空间构型是___________。(填“平面正方形”或“正四面体”)
(4)NH3中N原子的杂化方式是___________,硫元素对应的含氧酸酸性是H2SO4强于H2SO3,其原因为___________。
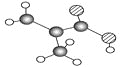
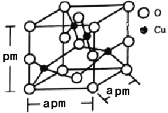
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是___________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为___________g/cm3。
【答案】[Ar]3d9或1s22s22p63s23p63d9 O 2NA或2×6.02×1023 C22-、CO、N2(其它答案合理均可以) NH3 极性 平面正方形 sp3 H2SO4与H2SO3分别可表示为(HO)2SO2和(HO)2SO,前者非羟基氧(2个)多于后者的非羟基氧(1个)的数目,使H2SO4中的S-O-H中的O的电子更偏向于S,越容易电离出H+,酸性更强 CuO 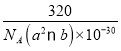
【解析】
(1)CuSO4和Cu(NO3)2中阳离子为Cu2+,Cu是29号元素,核外电子排布式为1s22s22p63s23p63d104s1,先失去4s能级1个电子,再失去3d能级1个形成Cu2+;元素的非金属性越强,其对键合电子吸引力就越强;
(2)共价单键只有1个σ键;共价双键含有1个σ键、1个π键;共价三键含有1个σ键、2个π键;原子总数相同、价电子总数也相同的微粒互为等电子体,CN-与N2互为等电子体,二者价键结构相同,即CN-中含有C≡N三键,三键含有1个σ键、2个π键;
(3)配位体中的中心原子提供孤对电子,根据Cu(NH3)2Cl2有两种同分异构体,结合相似性相溶原理分析物质的分子极性和空间构型;
(4)根据NH3的价层电子对数,得出杂化类型;
非金属含氧酸的酸性大小取决于非羟基氧的数目,非羟基氧原子数目越多,物质的酸性就越强;
(5)根据均摊法可以计算晶胞中含有的Cu、O原子个数,然后根据ρ=![]() 计算密度。
计算密度。
(1)CuSO4和Cu(NO3)2中阳离子为Cu2+,Cu是29号元素,核外电子排布式为1s22s22p63s23p63d104s1,先失去4s能级1个电子,再失去3d能级1个形成Cu2+,因此Cu2+的核外电子排布式是1s22s22p63s23p63d9,也可写为[Ar]3d9;元素的非金属性越强,其对键合电子吸引力越强,S、O、N三种元素的非金属性O>N>S,则三种原子对键合电子吸引力由大到小的顺序是O>N>S,所以对键合电子吸引力最大的是O;
(2)在CN-中存在C、N三键,其中含有1个σ键,两个π键,则1mol CN-中含有的π键的数目为2NA;
等电子体是指原子总数相同,价电子总数也相同的微粒,所以与CN-互为等电子体的离子有:C22-,分子有N2、CO;
(3)在[Cu(NH3)4]2+中,提供孤对电子的是配位体NH3分子中的N原子;Cu(NH3)2Cl2有两种同分异构体,其中一种易溶于水,根据相似相溶原理,水是极性分子,所以该分子应该为极性分子;既然存在两种同分异构体,所以[Cu(NH3)4]2+的空间构型应该是平面正方形;
(4)NH3的价层电子对数=3+![]() =4,所以N原子杂化类型为sp3杂化;
=4,所以N原子杂化类型为sp3杂化;
非金属含氧酸的酸性大小取决于非羟基氧的数目,H2SO4的非羟基氧2个,H2SO3的非羟基氧1个,使得H2SO4中的S-O-H中的O的电子更偏向于S,越容易电离出氢离子,酸性更强,所以酸性H2SO4强于H2SO3;
(5)如图所示,根据均摊法可以计算出Cu全部在体内:4个;O在顶点、面上、棱上和体心,即8×![]() +4×
+4×![]() +2×
+2×![]() +1=4,所以Cu和O原子个数最简整数比为1:1,因此物质的化学式为CuO;晶体密度ρ=
+1=4,所以Cu和O原子个数最简整数比为1:1,因此物质的化学式为CuO;晶体密度ρ=![]() =
=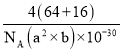 g/cm3=
g/cm3=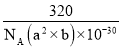 g/cm3。
g/cm3。

 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案