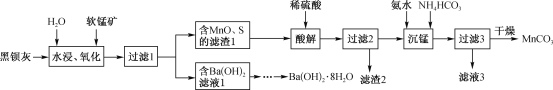
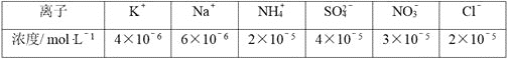
题目内容
【题目】运用元素周期律,判断下列语句,其中正确的组合是( )
①碱金属单质的熔点随原子序数的增大而降低
②砹(![]() )是第Ⅶ
)是第Ⅶ![]() 族,其氢化物的稳定性小于
族,其氢化物的稳定性小于![]()
③根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(![]() )与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥若X+和Y2﹣的核外电子层结构相同,则原子序数:X>Y
A.①③④B.①②⑥C.③④⑤D.②④⑥
【答案】B
【解析】
①由于从上到下元素的原子半径逐渐增大,所以金属单质Li、Na、K的熔点随原子序数的增大而降低,①正确;
②砹(At)是第VIIA族,非金属性Cl>At,其氢化物的稳定性小于HCl,②正确;
③Mg原子最外层电子处于其轨道的全充满状态,因此Mg的第一电离能比Al大,③错误;
④第二周期非金属元素的气态氢化物溶于水后,氨气的水溶液显碱性,甲烷不溶于水,HF的水溶液为酸性,④错误;
⑤铊(TI)与铝同主族,Tl的金属性大于Al,其单质只能与盐酸反应,⑤错误;
⑥若X+和Y2﹣的核外电子层结构相同,X+是原子失去最外层1个电子形成的,Y2-是原子获得2个电子形成的,所以原子序数:X>Y,⑥正确;
可见正确的说法是①②⑥,故合理选项是B。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】在一固定体积的密闭容器中,进行下列反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH=akJ·mol-1
CO(g)+H2O(g) ΔH=akJ·mol-1
其化学平衡常数K和温度T的关系如下表所示:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列有关叙述正确的是
A.a<0
B.可测量容器总压强变化来判定化学反应是否达到平衡
C.温度为830℃时,若c(CO2)·c(H2)>c(CO)·c(H2O),此时v正>v逆
D.温度不变,增大c(CO2),平衡右移,K增大