��Ŀ����
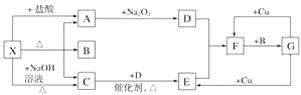
����Ŀ����ͼ��ʾÿһ�����ʾһ�ַ�Ӧ������������A��C��D��E��F��ͨ������¾�Ϊ���壬�Ҽ���X���ɵ�A��C�����ʵ���֮��Ϊ1��1��BΪ����Һ�塣
�Իش��������⣺
(1)X��________(�ѧʽ����ͬ)��F��__________��
(2)A�D��D��Ӧ�Ļ�ѧ����ʽΪ_______��
(3)G��Cu�ķ�Ӧ�У�G���ֵ�����Ϊ______��
(4)X�����NaOH��Һ��Ӧ����C�����ӷ���ʽΪ_____________��
(5)��C��B��DΪԭ�Ͽ�����G����ʹamol C��ȫת��ΪG��������������ҪD___ mol��
���𰸡�NH4HCO3 NO2 2Na2O2��2CO2=2Na2CO3��O2 ���Ժ������� NH4+��HCO3����2OH��=2H2O��CO32����NH3�� 2a
��������
X�������ᡢ�������Ʒ�Ӧ���������壬ӦΪ������Σ������ᷴӦ�õ�����A��A����������Ʒ�Ӧ��������D����AΪCO2��DΪO2��X���������Ʒ�Ӧ�õ�����CΪNH3��A��C���ʵ���֮��Ϊ1��1����BΪ����Һ�壬������֪XΪNH4HCO3��BΪH2O��C(����)��D(����)��Ӧ����EΪNO��E��������Ӧ����FΪNO2��F��ˮ��Ӧ�õ�G����Cu��Ӧ����NO��NO2����GΪHNO3���ݴ˽��
X�������ᡢ�������Ʒ�Ӧ���������壬ӦΪ������Σ������ᷴӦ�õ�����A��A����������Ʒ�Ӧ��������D����AΪCO2��DΪO2��X���������Ʒ�Ӧ�õ�����CΪNH3��A��C���ʵ���֮��Ϊ1��1����BΪ����Һ�壬������֪XΪNH4HCO3��BΪH2O��C(����)��D(����)��Ӧ����EΪNO��E��������Ӧ����FΪNO2��F��ˮ��Ӧ�õ�G����Cu��Ӧ����NO��NO2����GΪHNO3��
(1)������������֪��X��NH4HCO3��F��NO2��
(2) A��DΪNa2O2��CO2��Ӧ����̼���ƺ�O2��������Ӧ�Ļ�ѧ����ʽΪ2Na2O2��2CO2=2Na2CO3��O2��
(3) Cu�����ᷴӦ��������ͭ�뵪���������Ӧ��NԪ�صĻ��ϼ۲���Ϊ���仯�����ֽ��ͣ�������������ԡ������ԣ�
(4) NH4HCO3�����NaOH��Һ��Ӧ�����ӷ���ʽΪNH4+��HCO3����2OH��![]() 2H2O��CO32����NH3����
2H2O��CO32����NH3����
(5) ��NH3��H2O��O2Ϊԭ�Ͽ�����HNO3��ʹamolNH3��ȫת��ΪHNO3�����ݵ���ת���غ㣬������������Ҫ���������ʵ���=![]() =2amol��
=2amol��

 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д� Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д� �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�