题目内容
10.向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/L FeCl3溶液,静置.观察并记录现象| 步骤 | 向 MgCl2溶液中滴加NaOH溶液 | 向有白色沉淀的溶液中滴加FeCl3溶液 | 静置 |
| 现象 |
分析 氢氧化镁为白色难溶沉淀,加入氯化铁后,Fe(OH)3比Mg(OH)2更难溶,沉淀向着更难溶的物质转化,据此解答即可.
解答 解:氯化镁溶液会和氢氧化钠反应生成氢氧化镁白色沉淀,加入氯化铁,由于Fe(OH)3比Mg(OH)2更难溶,沉淀会向着更难溶的氢氧化铁转化,故答案为:生成白色沉淀;白色沉淀转化为红褐色的沉淀.
点评 本题考查学生金属铁以及化合物的性质方面的知识,属于综合知识的考查,注意知识的积累是解题的关键,难度不大.

练习册系列答案
相关题目
20.甲醇广泛用作燃料电池的燃料,可用天然气来合成.已知:
①2CH4 (g)+O2 (g)═2CO(g)+4H2(g)△H=-71.0 kJ•mol-1;
②CO(g)+2H2 (g)═CH3OH(l)△H=-90.5kJ•mol-1;
下列描述错误的是( )
①2CH4 (g)+O2 (g)═2CO(g)+4H2(g)△H=-71.0 kJ•mol-1;
②CO(g)+2H2 (g)═CH3OH(l)△H=-90.5kJ•mol-1;
下列描述错误的是( )
| A. | 反应①中的能量变化如图所示: | |
| B. | CO(g)+2H2 (g)═CH3OH(g)△H<-90.5kJ•mol-1 | |
| C. | 2CH4 (g)+3O2 (g)═2CO(g)+4H2O(g)△H<-71.0kJ•mol-1 | |
| D. | 2CH4 (g)+$\frac{1}{2}$O2 (g)═CH3OH( l))△H=-126.0kJ•mol-1 |
1.用下列装置进行相应实验,能达到实验目的是( )
| A. | 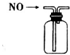 装置可收集NO气体 | |
| B. |  装置可吸收多余氨气且能防止倒吸 | |
| C. |  装置可实现反应:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | |
| D. | 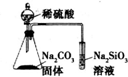 装置可证明非金属性:S>C>Si |
18. 控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )
控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )
 控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )
控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )| A. | 反应开始时,电子从甲池电极移向乙池电极 | |
| B. | 平衡时电流表指针为零,两池溶液颜色相同 | |
| C. | 平衡时Fe3+氧化性比I2强 | |
| D. | 平衡时向甲池中溶入FeCl2固体后,乙池的石墨电极为正极 |
2.以下收集气体装置中正确的是( )
| A. |  CO的收集 CO的收集 | B. |  NO的收集(液体为H2O) NO的收集(液体为H2O) | ||
| C. |  O2的收集 O2的收集 | D. |  NH3的收集(液体为H2O) NH3的收集(液体为H2O) |
4. 室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
 室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )| A. | a 点由水电离出的c(H+)=1.0×10-14 mol/L | |
| B. | b:c (NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)=c(NH4+) | |
| D. | d点后,溶液温度略有下降的主要原因是NH3•H2O电离吸热 |

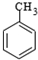 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$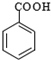
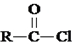
 .
.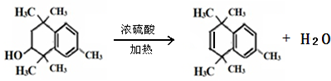 .
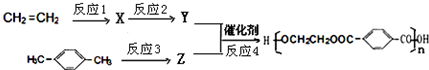
.
 .
.