题目内容
4. 室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )| A. | a 点由水电离出的c(H+)=1.0×10-14 mol/L | |
| B. | b:c (NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)=c(NH4+) | |
| D. | d点后,溶液温度略有下降的主要原因是NH3•H2O电离吸热 |
分析 A、氨水中的氢离子是水电离的,根据氨水中氢离子浓度大小进行判断;
B、b点时pH>7,盐酸和氨水反应,氨水过量,反应后溶质为氯化铵和氨水;
C、c点溶液的pH=7,为中性溶液,则c(H+)=c(OH-),根据电荷守恒进行判断;
D、d点盐酸与氨水的中和反应结束,导致温度不再升高.
解答 解:A、a点为氨水溶液,氨水中的氢离子为水电离的,由于a点溶液的pH<14,则溶液中氢离子浓度大于1.0×10-14mol•L-1,即:水电离出的c(H+)>1.0×10-14mol•L-1,故A错误;
B、盐酸和氨水反应,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知c(Cl-)=c(NH4+),b点时pH>7,则氨水过量,c(NH4+)+c(NH3•H2O)>c(Cl-),因同一溶液,溶液体积相同,所以n(NH4+)+n(NH3•H2O)>n(Cl-),故B正确;
C、c点pH=7,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知:c(Cl-)=c(NH4+),故C正确;
D、d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误;
故选BC.
点评 本题考查水溶液中的电离平衡以及酸碱中和滴定,题目难度中等,明确滴定曲线中各点的pH是解答的关键,并学会利用物料守恒、电荷守恒判断溶液中离子浓度大小.

练习册系列答案
相关题目
9.A、B、C、D、E是原子序数依次增大的短周期主族元素.A是电子数等于电子层数的非金属,B是地壳中含量最多的元素,C的族序数比A的族序数大1,D的次外层电子数等于最内层电子数和最外层电子数之和.下列叙述中正确的是( )
| A. | 元素的离子半径A<B<C<E | |
| B. | 工业上利用电解C的氯化物溶液的方法制备单质C | |
| C. | D的气态氢化物和最高价氧化物的水化物可能发生氧化还原反应 | |
| D. | D与C,A与D形成的化合物中化学键类型相同 |
10.向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/L FeCl3溶液,静置.观察并记录现象
| 步骤 | 向 MgCl2溶液中滴加NaOH溶液 | 向有白色沉淀的溶液中滴加FeCl3溶液 | 静置 |
| 现象 |
7.下列说法正确的是( )
| A. | 气体的摩尔体积是22.4L | |
| B. | 1L 1mol/L MgCl2溶液中Cl-的物质的量浓度为1mol/L | |
| C. | 1mol NaOH的质量为40g | |
| D. | 1mol氧和1mol水所含的分子数相等 |
9.下列说法正确的是( )
| A. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 | |
| B. | 二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理相同 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关 | |
| D. | 7.8g过氧化钠含有的共用电子对数为0.1NA |
16.下列反应生成物不受反应物的用量或浓度影响的是( )
| A. | 硫酸与氯化钠反应 | B. | 硝酸银溶液中滴加稀氨水 | ||
| C. | 铁在硫蒸气中燃烧 | D. | 铁粉加入硝酸中 |
14.如图是产生和收集气体的实验装置,该装置最适合( )
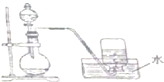

| A. | 氯酸钾和二氧化锰的混合物制取氧气 | |
| B. | 石灰石和盐酸制取二氧化碳 | |
| C. | 浓盐酸和二氧化锰制取氯气 | |
| D. | 铜与稀硝酸反应制取一氧化氮 |
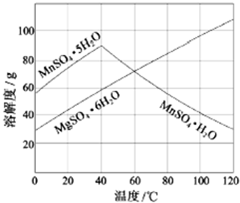 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4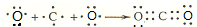 .
.