题目内容
15.下列物质:①干冰,②石英,③白磷,④氯仿(CHCl3),⑤过氧化钠.其中含极性键的非极性分子是( )| A. | ②③⑤ | B. | 仅②③ | C. | 仅① | D. | ①③④ |
分析 由不同非金属元素形成的化学键为极性键,由同种非金属元素形成的化学键为非极性键,只含非极性键的分子为非极性分子;若分子含有极性键,但结构对称,正负电荷的中心重合,则为非极性分子,极性分子中正负电荷的中心不重合,具有一定的极性,以此来解答.
解答 解:①干冰分子中碳原子与氧原子之间形成2对共用电子对,电子式为 ,含有碳氧极性键,为直线形分子,结构对称正负电荷重心重叠,为非极性分子,故①正确;
,含有碳氧极性键,为直线形分子,结构对称正负电荷重心重叠,为非极性分子,故①正确;
②石英成分为SiO2属于原子晶体,晶体中不存在分子,故②错误,
③白磷为单质,分子中只含有非极性键,属于非极性分子,故③错误;
④CH3Cl中含有极性键,空间结构为四面体,正负电荷的中心不重合,为极性分子,故④错误;
⑤过氧化钠中含有极性键,但为离子化合物,晶体中不存在分子,故⑤错误;
故选C.
点评 本题考查极性键和非极性键,熟悉常见元素之间的成键是解答本题的关键,注意化学键、空间构型与分子的极性的关系来分析解答即可,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.某有机物在酸性条件下发生水解反应时,生成两种不同有机物,且这两种有机物的分子式不同,但相对分子质量相等.则水解前的这种有机物是( )
| A. | 甲酸甲酯 | B. | 乙酸异丙酯 | C. | 麦芽糖 | D. | 蔗糖 |
6.下列物质在水溶液中存在着电离平衡的是( )
| A. | HF | B. | HNO3 | C. | C2H5OH(酒精) | D. | Na2SO4 |
3.对于反应4A+2B=3C,下列说法正确的是( )
| A. | 某温度时,化学反应速率无论用哪种物质表示,其数值是相等的 | |
| B. | 其他条件不变,降低温度,反应速率减慢 | |
| C. | 其他条件不变时,增大压强,化学反应速率一定加快 | |
| D. | 若增加或减少A的物质的量,反应速率一定会发生明显的变化 |
10.化学与生产、生活密切相关.下列说法不正确的是( )
| A. | 乙烯可作水果的催熟剂 | B. | SO2可用于杀菌消毒 | ||
| C. | 2H和3H可用于制造氢弹 | D. | 裂化汽油可用作萃取剂 |
20. 诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )
诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )
 诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )
诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )| A. | 能与氢气反应 | B. | 能与金属钠反应 | ||
| C. | 能与NaOH溶液反应 | D. | 不能与新制Cu(OH)2悬浊液反应 |
4.下列说法正确的是( )
| A. | 乙烯和聚乙烯都可以发生加成反应 | |
| B. | 甲苯分子中的所有碳原子共平面,聚乙烯分子中的所有碳原子共直线 | |
| C. | 乙酸乙酯、油脂分别在NaOH溶液中反应都有醇生成 | |
| D. | Ba2+中毒,可以吃煮熟的鸡蛋解毒 |
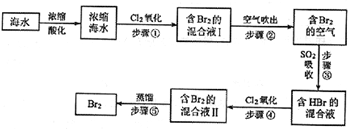
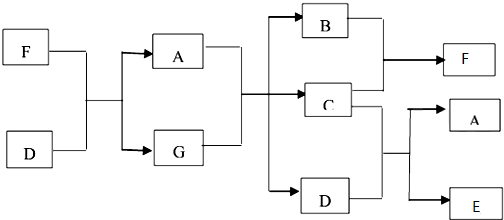
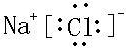 ,C
,C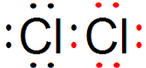 ,D
,D ,F
,F ,E
,E ;
;