题目内容
7.海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图: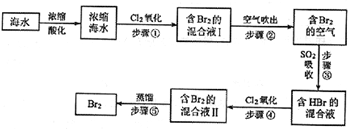
请回答下列问题.
(1)将海水浓缩的方法是蒸发;
(2)步骤①反应的离子方程式是Cl2+2Br-=2Cl-+Br2,1molCl2参加反应,转移电子2mol;
(3)步骤②通入热空气吹出Br2,利用了Br2的C(填序号);
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)步骤③中用SO2的水溶液吸收Br2,吸收率可达95%,该反应的氧化剂是Br2,在工业生产中此步骤应解决的问题是吸收尾气,防止污染空气.
分析 海水蒸发浓缩酸化得到浓缩海水通入氯气氧化溴离子得到含溴单质的混合溶液,利用热空气吹出Br2,被二氧化硫吸收得到含HBr的混合溶液,通入氯气氧化得到溴单质,富集溴元素得到含Br2的混合溶液Ⅱ,蒸馏得到溴单质,
(1)海水通过蒸发浓缩得到浓缩海水;
(2)步骤①是氯气氧化溴离子得到溴单质,依据元素化合价变化计算1molCl2参加反应,转移电子物质的量;
(3)通入热空气吹出Br2,利用了Br2的挥发性;
(4)用SO2的水溶液吸收Br2,氧化剂为溴单质,二氧化硫和溴蒸气有毒不能排放到空气中,应进行尾气吸收.
解答 解:海水蒸发浓缩酸化得到浓缩海水通入氯气氧化溴离子得到含溴单质的混合溶液,利用热空气吹出Br2,被二氧化硫吸收得到含HBr的混合溶液,通入氯气氧化得到溴单质,富集溴元素得到含Br2的混合溶液Ⅱ,蒸馏得到溴单质,
(1)海水通过蒸发浓缩得到浓缩海水,将海水浓缩的方法是蒸发,
故答案为:蒸发;
(2)步骤①是氯气氧化溴离子得到溴单质,反应的离子方程式是Cl2+2Br-=2Cl-+Br2,依据元素化合价变化计算1molCl2参加反应,转移电子物质的量为2mol,
故答案为:Cl2+2Br-=2Cl-+Br2,2;
(3)通入热空气吹出Br2,利用了Br2的挥发性,故选C,
故选C;
(4)用SO2的水溶液吸收Br2,氧化剂为溴单质,二氧化硫和溴蒸气有毒不能排放到空气中,应进行尾气吸收,
故答案为:Br2,吸收尾气,防止污染空气.
点评 本题考查了海水提溴的过程分析判断,主要是氧化还原反应和基本操作的理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
17.下列实验操作可以达到实验目的是( )
| 实验目的 | 实验操作 | |
| A. | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B. | 检验淀粉水解产物的还原性 | 取少量淀粉溶液,与稀硫酸共热后再加入银氨溶液,水浴加热,观察是否出现银镜 |
| C. | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和NaHCO3溶液,振荡,静置,分液,取出上层液体 |
| D. | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现白色沉淀 |
15.下列物质:①干冰,②石英,③白磷,④氯仿(CHCl3),⑤过氧化钠.其中含极性键的非极性分子是( )
| A. | ②③⑤ | B. | 仅②③ | C. | 仅① | D. | ①③④ |
19.下列说法正确的是( )
| A. | 1-丁烯、2-丁烯都存在顺反异构 | |
| B. | 乙二醇和丙三醇为同系物 | |
| C. | 正戊烷、异戊烷、新戊烷的沸点逐渐降低 | |
| D. | 淀粉、纤维、脂肪、蛋白质都是天然高分子化合物 |
16.除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处.
| 试剂 | 离子反应方程式 | |
| ①NaHCO3溶液(Na2CO3) | ||
| ②SiO2(CaCO3) |
17.据下列事实得出的结论正确的是( )
| A. | 试液→(KSCN溶液)→颜色无变化→(+氯水)→溶液变成血红色,证明溶液中含有Fe2+ | |
| B. | 试液→(焰色反应)→产生黄色,证明溶液为氢氧化钠溶液 | |
| C. | 试液→(+石蕊)→溶液呈蓝色,证明试液一定是碱溶液 | |
| D. | 混合气体→(通过澄清石灰水)→变浑浊,证明混合气体中一定含有二氧化碳 |
 .
.