题目内容
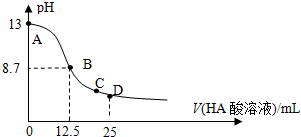
25℃时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L HA酸溶液,溶液pH变化曲线如图所示,仔细观察如图,判断有关说法中不正确的是( )

| A、HA酸是弱酸 |
| B、当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+) |
| C、在C点:c(Na+)>c(A-)>c(H+)>c(OH-) |
| D、在D点:c(A-)+c(HA)=2c(Na+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.根据图象曲线可知,当加入12.5mLHA溶液时,氢氧化钠与HA恰好反应生成NaA,溶液的pH=8.7,说明生成的盐为强碱弱酸盐;
B.当pH=7时,溶液显示中性,一定满足c(OH-)=c(H+),再根据电荷守恒可知c(Na+)=c(A-);
C.C点时溶液显示酸性,c(H+)>c(OH-),根据电荷守恒可知,c(Na+)<c(A-);
D.D点HA的总物质的量为氢氧化钠的2倍,根据物料守恒进行判断.
B.当pH=7时,溶液显示中性,一定满足c(OH-)=c(H+),再根据电荷守恒可知c(Na+)=c(A-);
C.C点时溶液显示酸性,c(H+)>c(OH-),根据电荷守恒可知,c(Na+)<c(A-);
D.D点HA的总物质的量为氢氧化钠的2倍,根据物料守恒进行判断.
解答:
解:A.加入12.5mLHA溶液时,NaOH与HA物质的量相等,二者恰好反应生成正盐NaA,而溶液的pH=8.7,溶液显示碱性,说明生成的是强碱弱酸盐,则HA为弱酸,故A正确;
B.当滴定过程中溶液pH=7时,溶液为中性,则c(OH-)=c(H+),根据电荷守恒可知,溶液中一定满足c(Na+)=c(A-),所以溶液中离子浓度大小为:c(Na+)=c(A-)>c(OH-)=c(H+),故B正确;
C.在C点溶液的pH<7,则c(H+)>c(OH-),根据溶液中电荷守恒可得:c(Na+)<c(A-),则溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.在D点时,n(NaOH)=0.025L×0.1mol/L=0.0025mol,n(HA)=0.02mol/L×0.025L=0.005mol,根据物料守恒可知c(Ac-)+c(HAc)=2c(Na+),故D正确;
故选C.
B.当滴定过程中溶液pH=7时,溶液为中性,则c(OH-)=c(H+),根据电荷守恒可知,溶液中一定满足c(Na+)=c(A-),所以溶液中离子浓度大小为:c(Na+)=c(A-)>c(OH-)=c(H+),故B正确;
C.在C点溶液的pH<7,则c(H+)>c(OH-),根据溶液中电荷守恒可得:c(Na+)<c(A-),则溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.在D点时,n(NaOH)=0.025L×0.1mol/L=0.0025mol,n(HA)=0.02mol/L×0.025L=0.005mol,根据物料守恒可知c(Ac-)+c(HAc)=2c(Na+),故D正确;
故选C.
点评:本题考查酸碱混合溶液pH的判断与计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,解答时从电解质的强弱以及酸碱混合反应的角度分析,注意分析曲线的变化特点,能够根据电荷守恒、物料守恒、盐的水解等知识判断溶液中离子浓度大小,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍.Z与其同主族的短周期元素可形成常见气体甲(甲有刺激性气味).X、Y、Z 三种元素形成化合物乙.下列说法不正确的是( )
| A、原子半径:W>Y>Z>M>X |
| B、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM |
| C、W与Z两元素形成的化合物是原子晶体 |
| D、化合物乙中一定只有共价键 |
某无色溶液放入铝片后有氢气产生,在该溶液中下列离子一定可以大量存在的是( )
| A、Na+ |
| B、Mg2+ |
| C、H+ |
| D、CO32- |
设NA为阿伏加德罗常数的数值,则下列说法正确的是( )
| A、2.24L C4H6中含有碳碳叁键数一定为0.1×6.02×1023 |
| B、在标准状态下,11.2L NO与11.2L O2混合后气体分子数为0.75NA |
| C、含1mol FeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA |
| D、106g Na2CO3固体中的阴离子数为NA |
下列图示与对应的叙述相符的是( )
A、 图中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化 |
B、 图表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强 |
C、 图为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
D、 图表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者pH的变化 |
从化学角度分析,下列叙述不正确的是( )
| A、化学是以实验为基础的一门学科,定量研究方法是化学发展为一门学科的重要标志 |
| B、铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等 |
| C、明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的净化 |
| D、高空中臭氧层能够吸收太阳紫外线,为地球上的生物提供了天然的保护屏障.但低空的臭氧是污染气体,会给人体造成伤害 |
 ⑥
⑥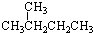 ⑦
⑦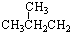 ⑧
⑧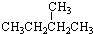
 ),其反应类型为:
),其反应类型为: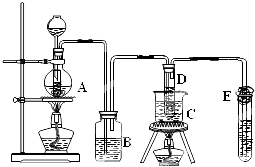 在实验室里制备KClO3,可利用如图所示的装置.实验中的化学原理:
在实验室里制备KClO3,可利用如图所示的装置.实验中的化学原理: