题目内容
设NA为阿伏加德罗常数的数值,则下列说法正确的是( )
| A、2.24L C4H6中含有碳碳叁键数一定为0.1×6.02×1023 |
| B、在标准状态下,11.2L NO与11.2L O2混合后气体分子数为0.75NA |
| C、含1mol FeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA |
| D、106g Na2CO3固体中的阴离子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.C4H6中不一定含有碳碳三键,可能含有两个碳碳双键,且不是标况下,无法计算其物质的量;
B.二氧化氮与四氧化二氮存在转化平衡,反应后混合气体的物质的量小于0.75mol;
C.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算氢氧化铁胶体中含有的胶粒数目;
D.碳酸钠固体中的阴离子为 碳酸根离子,106g碳酸钠的物质的量为1mol,含有1mol碳酸根离子.
B.二氧化氮与四氧化二氮存在转化平衡,反应后混合气体的物质的量小于0.75mol;
C.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算氢氧化铁胶体中含有的胶粒数目;
D.碳酸钠固体中的阴离子为 碳酸根离子,106g碳酸钠的物质的量为1mol,含有1mol碳酸根离子.
解答:
解:A.不是标况下,不能使用标况下的气体摩尔体积计算气体的物质的量;且C4H6中不一定含有碳碳三键,可能含有两个碳碳双键,故A错误;
B.标准状况下,11.2L NO的物质的量为0.5mol,11.2LO2的物质的量为0.5mol,二者反应生成了0.5mol二氧化氮,反应后还剩余0.25mol氧气,由于部分二氧化氮转化成四氧化二氮,所以反应后的气体小于0.75mol,混合后气体分子数小于0.75NA,故B错误;
C.由于氢氧化铁胶粒为氢氧化铁的聚集体,含1mol FeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子一定小于1mol,胶体粒子数目小于NA,故C错误;
D.106g碳酸钠的物质的量为1mol,1mol碳酸钠中有1mol碳酸根离子,含有的阴离子数为NA,故D正确;
故选D.
B.标准状况下,11.2L NO的物质的量为0.5mol,11.2LO2的物质的量为0.5mol,二者反应生成了0.5mol二氧化氮,反应后还剩余0.25mol氧气,由于部分二氧化氮转化成四氧化二氮,所以反应后的气体小于0.75mol,混合后气体分子数小于0.75NA,故B错误;
C.由于氢氧化铁胶粒为氢氧化铁的聚集体,含1mol FeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子一定小于1mol,胶体粒子数目小于NA,故C错误;
D.106g碳酸钠的物质的量为1mol,1mol碳酸钠中有1mol碳酸根离子,含有的阴离子数为NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确氢氧化铁胶粒为氢氧化铁的聚集体,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项B为易错点,注意二氧化氮与四氧化二氮之间存在转化平衡,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
25℃时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L HA酸溶液,溶液pH变化曲线如图所示,仔细观察如图,判断有关说法中不正确的是( )
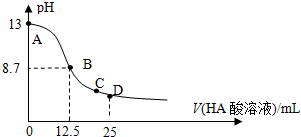

| A、HA酸是弱酸 |
| B、当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+) |
| C、在C点:c(Na+)>c(A-)>c(H+)>c(OH-) |
| D、在D点:c(A-)+c(HA)=2c(Na+) |
1L的密闭容器中有0.3mol A、0.1mol C和一定量B三种气体.一定条件下发生反应,各物质浓度随时间变化如图甲所示,t1时刻c(B)=0.1mol/L.图乙为t2时刻后改变条件反应速率随时间的变化情况,每次改变一种条件且条件各不相同,已知,t3时刻为加入催化剂,则下列判断正确的是( )
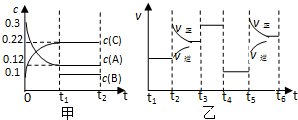

| A、t4时刻是增大容器的体积 |
| B、B的起始浓度为0.06mol/L |
| C、t1、t3、t6时刻相比,A物质的量最大的是t6时刻 |
| D、该可逆反应的方程式为:3A(g)?B(g)+2C(g) |
化学与社会生活密切相关,下列说法正确的是( )
| A、维勒打破了无机物和有机物的界限,汤姆生提出了带核的原子结构模型 |
| B、甲壳素、棉花、铜氨纤维、涤纶、光导纤维都是有机高分子材料 |
| C、“光化学烟雾”、“臭氧层空洞”、“温室效应”、“硝酸型酸雨”的形成都与氮氧化合物有关 |
| D、有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小有磁性,这种碳与金刚石的关系是同素异形体 |
用NA表示阿伏伽德罗常数.下列说法正确的是( )
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA |
| C、16.9gBaO2固体中阴、阳离子总数为0.2NA |
| D、含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA |
 奥运会中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
奥运会中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )| A、该物质与苯酚属于同系物 |
| B、1mol该物质与浓溴水反应时最多消耗Br2为4mol |
| C、该物质不能使酸性KMnO4溶液褪色 |
| D、该分子中的所有原子共平面 |
乙醇与乙酸在一定条件下反应生成乙酸乙酯,该反应类型属于( )
| A、加成反应 | B、酯化反应 |
| C、置换反应 | D、复分解反应 |
 ;则机理b是
;则机理b是
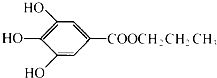 没食子酸丙酯简称PG,是一种白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.其结构简式如图所示.已知:PG经水解可转化为没食子酸,没食子酸能与NaHCO3溶液反应生成CO2
没食子酸丙酯简称PG,是一种白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.其结构简式如图所示.已知:PG经水解可转化为没食子酸,没食子酸能与NaHCO3溶液反应生成CO2