题目内容
下列图示与对应的叙述相符的是( )
A、 图中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化 |
B、 图表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强 |
C、 图为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
D、 图表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者pH的变化 |
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡
专题:图示题,电离平衡与溶液的pH专题
分析:A.醋酸为弱电解质,氯化氢为强电解质,所以等体积、等物质的量浓度的盐酸和醋酸溶液中盐酸中氢离子浓度大,与金属镁反应的速率快,反应需要的时间应该短;
B.先根据曲线判断消耗氢氧化钠溶液的体积相同,说明三种酸的最初浓度相同,再根据相同浓度时各种酸溶液的pH判断其酸性强弱;
C.从A到C,水的离子积增大,需要升高温度实现,而加入氢氧化钠固体后水的离子积不变,无法酸性从A到C;
D.稀释过程中铵根离子的水解程度增大,溶液中氢离子的物质的量增大,所以氯化铵溶液的pH始终需要氯化氢溶液的pH.
B.先根据曲线判断消耗氢氧化钠溶液的体积相同,说明三种酸的最初浓度相同,再根据相同浓度时各种酸溶液的pH判断其酸性强弱;
C.从A到C,水的离子积增大,需要升高温度实现,而加入氢氧化钠固体后水的离子积不变,无法酸性从A到C;
D.稀释过程中铵根离子的水解程度增大,溶液中氢离子的物质的量增大,所以氯化铵溶液的pH始终需要氯化氢溶液的pH.
解答:
解:A.醋酸为弱酸,盐酸为强酸,在物质的量浓度相等的条件下,盐酸和镁的反应速率快,所用时间少,应该盐酸与镁的反应优先结束,而图象变化与实际情况不相符,故A错误;
B.根据曲线可知,消耗氢氧化钠的体积相同,说明三种酸的物质的量浓度相同,氢氧化钠溶液体积我0时,溶液③的pH最小,说明③的酸性最强,故B正确;
C.根据图象曲线可知,从A点到C点,水的离子积常数增大,所以需要通过高温度来实现,而加入氢氧化钠固体不会影响水的离子积,故C错误;
D.稀释过程中会促进氯化铵的水解,溶液中氢离子的物质的量增加,所以在稀释过程中氯化铵溶液的pH应该小于盐酸的,图象曲线变化与实际不相符,故D错误;
故选B.
B.根据曲线可知,消耗氢氧化钠的体积相同,说明三种酸的物质的量浓度相同,氢氧化钠溶液体积我0时,溶液③的pH最小,说明③的酸性最强,故B正确;
C.根据图象曲线可知,从A点到C点,水的离子积常数增大,所以需要通过高温度来实现,而加入氢氧化钠固体不会影响水的离子积,故C错误;
D.稀释过程中会促进氯化铵的水解,溶液中氢离子的物质的量增加,所以在稀释过程中氯化铵溶液的pH应该小于盐酸的,图象曲线变化与实际不相符,故D错误;
故选B.
点评:本题考查弱电解质的电离、酸碱中和滴定、水的离子积常数以及盐类水解等知识,该题是高考中的常见题型,属于中等难度的试题.试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,有利于培养学生的逻辑推理能力和抽象思维能力.该题的关键是明确各种平衡状态的特点以及外界条件对平衡状态的影响,然后结合图象,灵活分析、判断即可.

练习册系列答案
相关题目
25℃时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L HA酸溶液,溶液pH变化曲线如图所示,仔细观察如图,判断有关说法中不正确的是( )
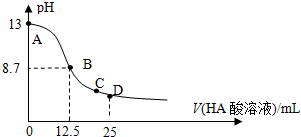

| A、HA酸是弱酸 |
| B、当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+) |
| C、在C点:c(Na+)>c(A-)>c(H+)>c(OH-) |
| D、在D点:c(A-)+c(HA)=2c(Na+) |
化学与社会生活密切相关,下列说法正确的是( )
| A、维勒打破了无机物和有机物的界限,汤姆生提出了带核的原子结构模型 |
| B、甲壳素、棉花、铜氨纤维、涤纶、光导纤维都是有机高分子材料 |
| C、“光化学烟雾”、“臭氧层空洞”、“温室效应”、“硝酸型酸雨”的形成都与氮氧化合物有关 |
| D、有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小有磁性,这种碳与金刚石的关系是同素异形体 |
用NA表示阿伏伽德罗常数.下列说法正确的是( )
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA |
| C、16.9gBaO2固体中阴、阳离子总数为0.2NA |
| D、含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA |
为了除去蛋白质溶液中混有的少量食盐,可采用的方法是( )
| A、过滤 | B、渗析 | C、萃取 | D、重结晶 |
 奥运会中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
奥运会中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )| A、该物质与苯酚属于同系物 |
| B、1mol该物质与浓溴水反应时最多消耗Br2为4mol |
| C、该物质不能使酸性KMnO4溶液褪色 |
| D、该分子中的所有原子共平面 |
化学已渗透到人类生活的各个方面,下列说法不正确的是( )
| A、用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 |
| B、神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,是一种新型无机非金属材料 |
| C、在入海口的钢铁闸门上装一定数量的锌块可防止闸门被腐蚀 |
| D、为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
下列化学用语或名称的表达正确的是( )
A、 与 与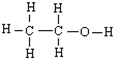 都可以用来描述乙醇的结构 都可以用来描述乙醇的结构 | ||||||||
B、最近合成117号元素的反应为:
| ||||||||
| C、中学阶段对氮原子核外电子运动状态描述最详尽的是:1s22s22p3 | ||||||||
D、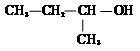 该有机物的系统名称为:2-甲基-1-丙醇 该有机物的系统名称为:2-甲基-1-丙醇 |
 b.
b. c.
c.