题目内容
禽流感在全球的蔓延,使人们谈“禽”色变.从香料八角中提取的莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一,达菲是抗禽流感病毒特效药物.
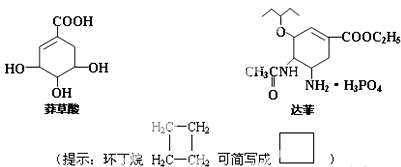
(1)达菲分子中含有的常见官能团有 ;
(2)莽草酸在浓硫酸作用下加热可以得到B(B的结构简式为: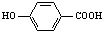 ),其反应类型为: ;
),其反应类型为: ;
(3)请写出莽草酸与乙醇反应的化学方程式(有机物用结构简式表示): ;
(4)B的同分异构体中既含有酚羟基又含有酯基的共3种,写出其中一种同分异构体的结构简式 .

(1)达菲分子中含有的常见官能团有
(2)莽草酸在浓硫酸作用下加热可以得到B(B的结构简式为:
 ),其反应类型为:
),其反应类型为:(3)请写出莽草酸与乙醇反应的化学方程式(有机物用结构简式表示):
(4)B的同分异构体中既含有酚羟基又含有酯基的共3种,写出其中一种同分异构体的结构简式
考点:有机物的结构和性质,有机物分子中的官能团及其结构
专题:有机物的化学性质及推断
分析:(1)根据结构简式判断官能团;
(2)A中含-OH,-OH减少,有不饱和键生成;
(3)莽草酸与乙醇反应为酯化反应;
(4)B的同分异构体中既含有酚羟基又含有酯基,则取代基为-OOCH、-OH,存在邻、间、对位置.
(2)A中含-OH,-OH减少,有不饱和键生成;
(3)莽草酸与乙醇反应为酯化反应;
(4)B的同分异构体中既含有酚羟基又含有酯基,则取代基为-OOCH、-OH,存在邻、间、对位置.
解答:
解:(1)由结构简式可知,分子中含碳碳双键、酯基、醚键及肽键,故答案为:碳碳双键、酯基、醚键及肽键;
(2)莽草酸在浓硫酸作用下加热可以得到B,-OH减少,有不饱和键生成,则为醇的消去反应,故答案为:消去反应;
(3)莽草酸与乙醇反应为酯化反应,该反应为 ,
,
故答案为: ;
;
(4)B的同分异构体中既含有酚羟基又含有酯基,则取代基为-OOCH、-OH,存在邻、间、对位置,其中一种同分异构体的结构简式为 ,
,
故答案为: .
.
(2)莽草酸在浓硫酸作用下加热可以得到B,-OH减少,有不饱和键生成,则为醇的消去反应,故答案为:消去反应;
(3)莽草酸与乙醇反应为酯化反应,该反应为
 ,
,故答案为:
 ;
;(4)B的同分异构体中既含有酚羟基又含有酯基,则取代基为-OOCH、-OH,存在邻、间、对位置,其中一种同分异构体的结构简式为
 ,
,故答案为:
 .
.
点评:本题考查有机物的结构和性质,明确常见有机物中的官能团及其性质是解答本题的关键,熟悉羧酸、醇的化学性质即可解答,(4)为解答的难点,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、氯化钠熔化或氯化氢溶于水时都要破坏化学键 |
| B、常温常压下,18g D2O含有6.02×1024个电子 |
| C、标准状况下,11.2L SO3所含3.01×1023个分子 |
| D、离子化合物中可能含有共价键,共价化合物中一定不含有离子键 |
25℃时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L HA酸溶液,溶液pH变化曲线如图所示,仔细观察如图,判断有关说法中不正确的是( )
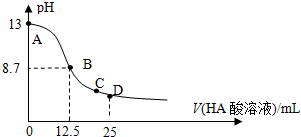

| A、HA酸是弱酸 |
| B、当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+) |
| C、在C点:c(Na+)>c(A-)>c(H+)>c(OH-) |
| D、在D点:c(A-)+c(HA)=2c(Na+) |
化学与社会生活密切相关,下列说法正确的是( )
| A、维勒打破了无机物和有机物的界限,汤姆生提出了带核的原子结构模型 |
| B、甲壳素、棉花、铜氨纤维、涤纶、光导纤维都是有机高分子材料 |
| C、“光化学烟雾”、“臭氧层空洞”、“温室效应”、“硝酸型酸雨”的形成都与氮氧化合物有关 |
| D、有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小有磁性,这种碳与金刚石的关系是同素异形体 |
化学已渗透到人类生活的各个方面,下列说法不正确的是( )
| A、用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 |
| B、神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,是一种新型无机非金属材料 |
| C、在入海口的钢铁闸门上装一定数量的锌块可防止闸门被腐蚀 |
| D、为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
 b.
b. c.
c.
 氮的固定是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol.回答下列问题:
氮的固定是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol.回答下列问题: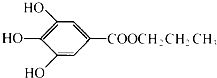 没食子酸丙酯简称PG,是一种白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.其结构简式如图所示.已知:PG经水解可转化为没食子酸,没食子酸能与NaHCO3溶液反应生成CO2
没食子酸丙酯简称PG,是一种白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.其结构简式如图所示.已知:PG经水解可转化为没食子酸,没食子酸能与NaHCO3溶液反应生成CO2