题目内容
某无色溶液放入铝片后有氢气产生,在该溶液中下列离子一定可以大量存在的是( )
| A、Na+ |
| B、Mg2+ |
| C、H+ |
| D、CO32- |
考点:铝的化学性质,离子共存问题
专题:离子反应专题,几种重要的金属及其化合物
分析:某无色溶液放入铝片后有氢气产生,为非氧化性酸或强碱溶液,能反应的离子不能大量共存,以此来解答.
解答:
解:某无色溶液放入铝片后有氢气产生,为非氧化性酸或强碱溶液,碱溶液中不能存在Mg2+、H+,酸溶液中不能存在CO32-,只有A与酸、碱均不反应,可大量存在,
故选A.
故选A.
点评:本题考查Al的性质及离子共存,为高频考点,把握习题中的信息及常见离子的反应为解答的关键,侧重分析能力及知识应用能力的考查,题目难度不大.

练习册系列答案
相关题目
下列化学用语表述正确的是( )
| A、CH3COONH4的电离方程式为:CH3COONH4═CH3COO-+NH4+ | ||||
| B、NaHS的水解方程式为:HS-+H2O═S2-+H3O+ | ||||
| C、次氯酸的结构式为:H-O-Cl | ||||
D、过量Fe粉与Cl2反应的化学方程式为:Fe+Cl2
|
25℃时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L HA酸溶液,溶液pH变化曲线如图所示,仔细观察如图,判断有关说法中不正确的是( )
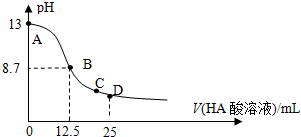

| A、HA酸是弱酸 |
| B、当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+) |
| C、在C点:c(Na+)>c(A-)>c(H+)>c(OH-) |
| D、在D点:c(A-)+c(HA)=2c(Na+) |
化学与社会生活密切相关,下列说法正确的是( )
| A、维勒打破了无机物和有机物的界限,汤姆生提出了带核的原子结构模型 |
| B、甲壳素、棉花、铜氨纤维、涤纶、光导纤维都是有机高分子材料 |
| C、“光化学烟雾”、“臭氧层空洞”、“温室效应”、“硝酸型酸雨”的形成都与氮氧化合物有关 |
| D、有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小有磁性,这种碳与金刚石的关系是同素异形体 |
为了除去蛋白质溶液中混有的少量食盐,可采用的方法是( )
| A、过滤 | B、渗析 | C、萃取 | D、重结晶 |
下列说法正确的是( )
| A、稀豆浆和雾均能产生丁达尔现象 |
| B、糖类、油脂、蛋白质均能发生水解反应 |
| C、煤经气化和液化两个物理变化过程变为清洁能源 |
| D、海水是一个巨大的宝藏,如氯、溴、碘、硫、钠、钾等元素主要来自于海水 |
 氮的固定是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol.回答下列问题:
氮的固定是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol.回答下列问题: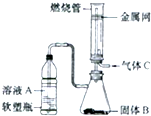 实验室可将硬质玻璃管改装为燃烧管(如图所示).挤压软塑料瓶壁,向装有固体B的锥形瓶中加入液体A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).若用此装置模拟工业制氯化氢,则关于试剂选择正确的是( )
实验室可将硬质玻璃管改装为燃烧管(如图所示).挤压软塑料瓶壁,向装有固体B的锥形瓶中加入液体A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).若用此装置模拟工业制氯化氢,则关于试剂选择正确的是( )