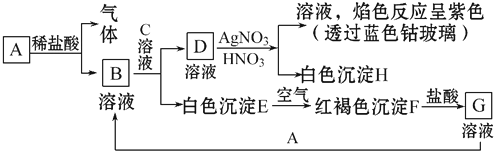
题目内容
15.现有X、Y两种原子,X原子的M层比Y原子的M层少3个电子,Y原子L层的电子数为X原子L层电子数的2倍,则X和Y分别是( )| A. | 硅原子和钠原子 | B. | 硼原子和氦原子 | C. | 氯原子和碳原子 | D. | 碳原子和铝原子 |
分析 X原子的M层比Y原子的M层少3个电子,说明Y原子的L层已经排满8个电子,Y原子L层的电子数为X原子L层电子数的2倍,则X原子L层电子数为4,故Y原子的M层电子数为3,据此判断X、Y元素.
解答 解:X原子的M层比Y原子的M层少3个电子,说明Y原子的L层已经排满8个电子,Y原子L层的电子数为X原子L层电子数的2倍,则X原子L层电子数为4,故X为碳元素,碳原子的M层电子数为0,所以Y原子的M层电子数为3,故Y为铝元素.
故选:D.
点评 本题主要考查核外电子排布规律、原子结构与位置关系等,难度不大,理解核外电子排布规律并能灵活运用.

练习册系列答案
相关题目
6.为了确定有机物中是否存在氮、氯、溴、硫等元素,应将有机物样品与下列哪种金属混合熔融后,再无机定性分析( )
| A. | Fe | B. | Si | C. | Cu | D. | Na |
3.在下列变化过程中,被破坏的作用力正确的是( )
| A. | 干冰升华--共价键 | B. | 二氧化硅熔融--分子间作用力 | ||
| C. | 氢氧化钠熔融--离子键、共价键 | D. | 硫酸氢钠溶于水--离子键、共价键 |
10.下列属于放热反应的是( )
| A. | 浓硫酸的稀释 | B. | 铝热反应 | ||
| C. | 氢气还原氧化铜 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
20.下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
| A. | 氯化铵与苯分别受热变为气体 | B. | 氯化钠与氯化氢分别溶解在水中 | ||
| C. | 碘与干冰分别受热变为气体 | D. | NaHSO4受热熔化与溶于水变为溶液 |
7.根据下列四种粒子的结构示意图,所获取的信息不正确的是( )
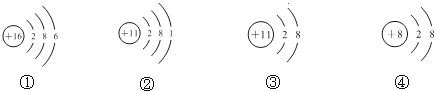
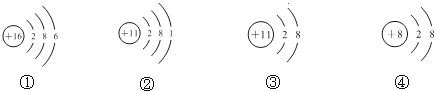
| A. | 它们表示三种元素 | |
| B. | ②③的化学性质相同 | |
| C. | ②表示的元素是金属元素 | |
| D. | ①表示的是原子,而④表示的是阴离子 |
4.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 已知Ra是第七周期、IIA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强 | |
| B. | 已知As是第四周期、VA族的元素,故AsH3 的稳定性比NH3的稳定性强 | |
| C. | 已知Cs原子半径比Na的原子半径大,故Cs与水反应比Na与比反应更剧烈 | |
| D. | 已知Cl与Al处于同一周期,且Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小 |