题目内容
4.运用元素周期律分析下面的推断,其中错误的是( )| A. | 已知Ra是第七周期、IIA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强 | |
| B. | 已知As是第四周期、VA族的元素,故AsH3 的稳定性比NH3的稳定性强 | |
| C. | 已知Cs原子半径比Na的原子半径大,故Cs与水反应比Na与比反应更剧烈 | |
| D. | 已知Cl与Al处于同一周期,且Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小 |
分析 A、同主族从上往下金属性增加,所以最高价氧化物对应水化物的碱性增加;
B、非金属性越强,对应的氢化物越稳定;
C、原子半径越大,原子核对核外电子吸引能力越弱,元素的金属性越强;
D、同周期核电荷数越大,原子核对核外电子吸引能力越强,原子半径减小.
解答 解:A.同主族自上而下元素金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:Ra(OH)2>Mg(OH)2,故A正确;
B.同主族自上而下元素非金属性减弱,故非金属性N>As,非金属性越强,其氢化物越稳定,故氢化物稳定性:AsH3<NH3,故B错误;
C.Cs的原子半径比Na的原子半径大,原子半径越大,原子核对核外电子吸引能力越弱,故Cs的金属性较强,Cs与水反应比Na与水反应更剧烈,故C正确;
D.Cl的核电荷数比Al的核电荷数大,核电荷数越大,原子核对核外电子吸引能力越强,故Cl的原子半径比Al的原子半径小,故D正确,
故选B.
点评 本题考查元素周期律,难度不大,注意根据原子结构理解同周期、同主族元素性质的递变规律.

练习册系列答案
相关题目
14.已知直链烷烃A比B多一个碳原子,则下列说法正确的是( )
| A. | A沸点比B高 | |
| B. | A相对密度比B小 | |
| C. | 一般情况下,同碳原子的烷烃的沸点和密度低于烯烃 | |
| D. | 已知A在常温下为液态,则B不可能为气态 |
15.现有X、Y两种原子,X原子的M层比Y原子的M层少3个电子,Y原子L层的电子数为X原子L层电子数的2倍,则X和Y分别是( )
| A. | 硅原子和钠原子 | B. | 硼原子和氦原子 | C. | 氯原子和碳原子 | D. | 碳原子和铝原子 |
9.下列各组中两种微粒所含电子数不相等的是( )
| A. | H3O+ 和OH- | B. | CO和N2 | C. | HNO2和NO2- | D. | CH3+ 和NH4+ |
16.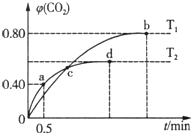 利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )
 利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )| A. | T2时,0~0.5 min内的反应速率v(CO)=1.6mol/(L•min) | |
| B. | 两种温度下,c点时体系中混合气体的压强相等 | |
| C. | d点时,增大体系压强,CO的转化率不变 | |
| D. | b点和d点时化学平衡常数的大小关系:Kb>Kd |
13.下列离子方程式书写正确的是( )
| A. | 澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| B. | 过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O | |
| C. | 氧化亚铁溶于稀盐酸:FeO+2H+=Fe2++H2O | |
| D. | 氢氧化钡溶液中加过量小苏打:Ba2++OH-+HCO3-=BaCO3↓+H2O. |
14.下列实验操作中正确的是( )
| A. | 将溴水、铁粉和苯混合加热即可制得溴苯 | |
| B. | 除去溴苯中红棕色的溴,可用稀NaOH溶液反复洗涤,再用分液漏斗分液 | |
| C. | 用苯和浓HNO3、浓H2SO4反应制取硝基苯时需水浴加热,温度计应放在反应混合液中 | |
| D. | 制取硝基苯时,应先向试管中加入浓H2SO4 2 mL,再加入1.5 mL浓HNO3,再滴入苯约1 mL,然后放在水浴中加热 |

 .
. .
. 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷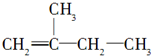 2-甲基-1丁烯
2-甲基-1丁烯 .
. .
. 分子式为C10H20,按碳的骨架分,该有机物属于ab.(填字母序号)
分子式为C10H20,按碳的骨架分,该有机物属于ab.(填字母序号)