题目内容
5.已知有如图所示物质的相互转化,试回答: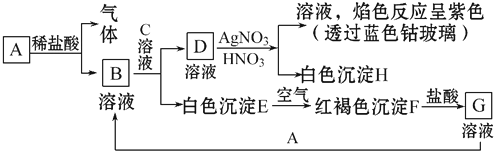
(1)写出B的化学式FeCl2,D的化学式KCl.
(2)写出由E转变成F的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)向G溶液中加入A时反应的离子方程式为2Fe3++Fe=3Fe2+.
(4)A与稀盐酸反应生成0.1mol气体,转移电子数为0.2NA.
分析 D与硝酸银、硝酸反应得到的溶液,进行焰色反应显紫色,说明D溶液中含有K元素,D能和硝酸银溶液反应生成白色沉淀H为AgCl,所以D应该是KCl.白色沉淀E在空气中转化为红褐色沉淀,则E为Fe(OH)2、F为Fe(OH)3,G为FeCl3.B和C反应生成氯化钾和氢氧化亚铁,所以B、C分别是氢氧化钾、氯化亚铁中的一种,G能和A反应生成B,所以A是Fe,B是为FeCl2,C是KOH,Fe与盐酸反应得到氯化亚铁与氢气,据此解答.
解答 解:D与硝酸银、硝酸反应得到的溶液,进行焰色反应显紫色,说明D溶液中含有K元素,D能和硝酸银溶液反应生成白色沉淀H为AgCl,所以D应该是KCl.白色沉淀E在空气中转化为红褐色沉淀,则E为Fe(OH)2、F为Fe(OH)3,G为FeCl3.B和C反应生成氯化钾和氢氧化亚铁,所以B、C分别是氢氧化钾、氯化亚铁中的一种,G能和A反应生成B,所以A是Fe,B是为FeCl2,C是KOH,Fe与盐酸反应得到氯化亚铁与氢气,
(1)由上述分析可知,B的化学式为FeCl2,D的化学式为KCl,故答案为:FeCl2;KCl;
(2)由E转变成F的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)向氯化铁溶液加入Fe的有关离子反应方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(4)Fe与盐酸发生反应:Fe+2HCl=FeCl2+H2↑,生成0.1mol氢气,转移电子数为0.1mol×2×NAmol-1=0.2NA,故答案为:0.2NA.
点评 本题考查无机物推断,是高考中的常见题型,属于中等难度.试题综合性强,难易适中,侧重对学生基础知识的巩固与训练,焰色反应及物质的颜色、特殊反应现象为推断突破口,需要学生熟练掌握元素化合物性质.

| A. | 硅原子和钠原子 | B. | 硼原子和氦原子 | C. | 氯原子和碳原子 | D. | 碳原子和铝原子 |
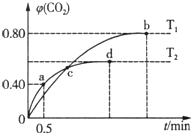 利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )| A. | T2时,0~0.5 min内的反应速率v(CO)=1.6mol/(L•min) | |
| B. | 两种温度下,c点时体系中混合气体的压强相等 | |
| C. | d点时,增大体系压强,CO的转化率不变 | |
| D. | b点和d点时化学平衡常数的大小关系:Kb>Kd |
| A. | 澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| B. | 过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O | |
| C. | 氧化亚铁溶于稀盐酸:FeO+2H+=Fe2++H2O | |
| D. | 氢氧化钡溶液中加过量小苏打:Ba2++OH-+HCO3-=BaCO3↓+H2O. |
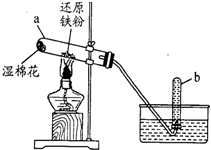
| A. | 甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰 | |
| B. | 乙同学认为试管a中生成的黑色固体可能为四氧化三铁 | |
| C. | 丙同学认为将少量还原性铁粉放入试管中,加适量的水,加热也可实现该反应 | |
| D. | 丁同学认为可用盐酸和KSCN溶液来验证产物中的三价铁 |
| A. | 具有同质量、不同体积的N2O和CO2 | B. | 具有同温度、同体积的CO和N2 | ||
| C. | 具有同体积、同密度的SO2和NO2 | D. | 具有同密度、不同质量的O2和O3 |
| A. | 将溴水、铁粉和苯混合加热即可制得溴苯 | |
| B. | 除去溴苯中红棕色的溴,可用稀NaOH溶液反复洗涤,再用分液漏斗分液 | |
| C. | 用苯和浓HNO3、浓H2SO4反应制取硝基苯时需水浴加热,温度计应放在反应混合液中 | |
| D. | 制取硝基苯时,应先向试管中加入浓H2SO4 2 mL,再加入1.5 mL浓HNO3,再滴入苯约1 mL,然后放在水浴中加热 |
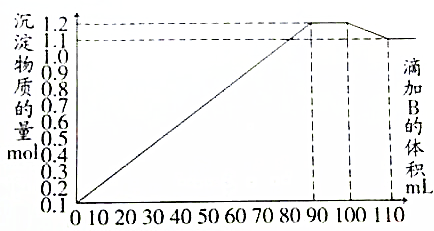
| A. | 加入90mL B时,A溶液中金属离子沉淀完全 | |
| B. | 加入110mL B时,沉淀物仅为BaSO4 | |
| C. | B溶液中Na2SO4和NaOH的物质的量浓度之比为1:1 | |
| D. | 当溶液中含有NaAlO2时,加入溶液B的体积V(B)≥100mL |