题目内容
6.为了确定有机物中是否存在氮、氯、溴、硫等元素,应将有机物样品与下列哪种金属混合熔融后,再无机定性分析( )| A. | Fe | B. | Si | C. | Cu | D. | Na |
分析 根据N、Cl、Br、S等元素与金属钠混合熔融,分别以氮化钠、氯化钠、溴化钠、硫化钠等的形式存在分析.
解答 解:确定是否含有N、Cl、Br、S等元素,采用钠融法:将有机样品与金属钠混合熔融,氮、氯、溴、硫等元素分别以氮化钠、氯化钠、溴化钠、硫化钠等的形式存在,再用无机定性分析法测定,故选:D.
点评 本题考查了常见的研究物理问题的方法的具体应用,要通过练习体会这些方法的重要性,培养学科思想.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| B. | 相同浓度和体积的强酸与强碱溶液混合后,溶液的PH=7 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 若反应2A(g)+B(g)=2C(g)在一定条件下是一个自发的反应,则该反应为吸热反应 |
14.已知直链烷烃A比B多一个碳原子,则下列说法正确的是( )
| A. | A沸点比B高 | |
| B. | A相对密度比B小 | |
| C. | 一般情况下,同碳原子的烷烃的沸点和密度低于烯烃 | |
| D. | 已知A在常温下为液态,则B不可能为气态 |
1.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)?NH3(g)+HI(g);
②2HI(g)?H2(g)+I2(g)
达到平衡时,c(H2)=0.25mol/L,c(HI)=5mol/L,
则此温度下反应①的平衡常数(单位:mol2•L-2)为( )
①NH4I(s)?NH3(g)+HI(g);
②2HI(g)?H2(g)+I2(g)
达到平衡时,c(H2)=0.25mol/L,c(HI)=5mol/L,
则此温度下反应①的平衡常数(单位:mol2•L-2)为( )
| A. | 25 | B. | 0.025 | C. | 30.25 | D. | 27.5 |
11.食盐(NaCl)是生活中常用的调味品,HCl是胃酸的主要成分,下列关于两种物质的说法正确的是( )
| A. | 炒菜时放入食盐并不破坏NaCl中的化学键 | |
| B. | HCl的电子式是 | |
| C. | NaCl熔化时破坏共价键 | |
| D. | HCl的结构式是H-Cl |
18.将下列浓溶液蒸干并灼烧,可以得到原溶质的是( )
| A. | 氯化钠 | B. | 碳酸氢钠 | C. | 偏铝酸钠 | D. | 氯化铁 |
15.现有X、Y两种原子,X原子的M层比Y原子的M层少3个电子,Y原子L层的电子数为X原子L层电子数的2倍,则X和Y分别是( )
| A. | 硅原子和钠原子 | B. | 硼原子和氦原子 | C. | 氯原子和碳原子 | D. | 碳原子和铝原子 |
16.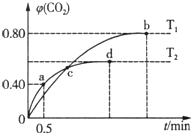 利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )
 利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )| A. | T2时,0~0.5 min内的反应速率v(CO)=1.6mol/(L•min) | |
| B. | 两种温度下,c点时体系中混合气体的压强相等 | |
| C. | d点时,增大体系压强,CO的转化率不变 | |
| D. | b点和d点时化学平衡常数的大小关系:Kb>Kd |
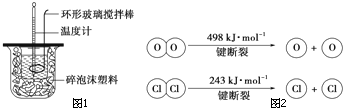 针对化学反应中的能量变化解决下列问题.
针对化学反应中的能量变化解决下列问题.