题目内容
3.在标准状况下,CO、H2、CO2的混合气体50L与20L O2(足量)点燃爆炸,当恢复到标准状况时,测得气体体积为37L,用NaOH处理后剩余气体为3L,求原混合物中各气体的体积分数.分析 氧气足量,则最后剩余的3L气体为氧气,说明反应消耗了17L氧气;设出CO、H2、CO2的体积,然后根据总体积、消耗氧气的体积、生成二氧化碳的体积分别列式,从而计算出三者体积,最后分别计算出各气体的体积分数即可.
解答 解:一氧化碳、氢气燃烧的方程式为:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2、2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O(l),
2 1 2 2 1
设混合气体中含有CO、H2、CO2的体积分别为x、y、z,则①x+y+z=50L,
燃烧后的产物用NaOH处理后剩余的3L气体为氧气,则一氧化碳和氢气燃烧消耗氧气的体积为:20L-3L=17L,即:②0.5x+0.5y=17L,
反应后的37L气体中含有3L氧气,则含有二氧化碳的物质的量为:37L-3L=34L,即:③x+z=34L,
联立①②③解得:x=18L、y=16L、z=16L,
原混合物中CO的体积分数为:$\frac{18L}{50L}$×100%=36%,氢气的体积分数=二氧化碳的体积分数=$\frac{16L}{50L}$×100%=32%,
答:原混合物中CO的体积分数为36%,氢气的体积分数为32%,二氧化碳的体积分数为32%.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意标准状况下水的状态为液态,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
14.下列关于NA的说法中,不正确的是( )
| A. | 2NA个H2与NA个O2的质量比为1:8 | |
| B. | 0.5NA个HCl所占的体积约为11.2L | |
| C. | 71gCl2所含的Cl数目为2NA | |
| D. | 1L 0.5mol•L-1FeCl3溶液中含有1.5NA个Cl- |
11.下列关于“摩尔”的理解正确的是( )
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 我们把含有6.02×1023个粒子的任何粒子的集体计量为1摩尔 | |
| C. | 摩尔是表示物质的粒子个数的单位,简称摩,符号为mol | |
| D. | 1mol氧含6.02×1023个O2 |
8.下列离子方程式正确的是( )
| A. | 碳酸钙中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 少量SO2通入NaOH溶液:SO2+OH-═HSO3- | |
| C. | FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| D. | 硫酸溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ |
19.下列说法正确的是( )
| A. | 若高分子对应的单体只有一种,则此高聚物与单体一定有相同的最简式 | |
| B. | 等物质的量的乙烯与乙醇充分燃烧时消耗氧气的质量不相等 | |
| C. | 分子式为C6H12的某链状有机物,且6个碳原子一定在同一平面上,则与氢气加成后产物的名称为:2,3一二甲基丁烷 | |
| D. | 有机物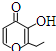 的一种芳香族同分异构体能发生银镜反应 的一种芳香族同分异构体能发生银镜反应 |
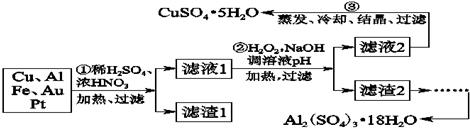
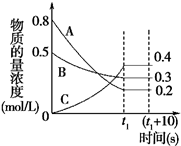 如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题: