题目内容
8.下列离子方程式正确的是( )| A. | 碳酸钙中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 少量SO2通入NaOH溶液:SO2+OH-═HSO3- | |
| C. | FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| D. | 硫酸溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ |
分析 A.碳酸钙为沉淀,应保留化学式;
B.二氧化硫少量反应生成亚硫酸钠;
C.氯气足量,亚铁离子和溴离子都完全被氯气氧化;
D.漏掉氢离子与氢氧根离子的反应.
解答 解:A.碳酸钙中加入盐酸,离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+,故A错误;
B.少量SO2通入NaOH溶液,离子方程式:SO2+2OH-═H2O+SO32-,故B错误;
C.向FeBr2溶液中通入足量氯气,亚铁离子和溴离子完全被氧化,反应的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故C正确;
D.硫酸溶液与氢氧化钡溶液混合,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的正误判断,掌握离子方程式的书写原则,明确离子方程式正误判断常用方法是解题关键,注意化学式的拆分,题目难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
19.实验室中需要配制2mol/L的NaOH溶液850mL,配制时应选用的容量瓶的规格和称取的NaOH的质量分别是( )
| A. | 950mL,76g | B. | 500mL,80g | C. | 1000mL,80g | D. | 1000mL,76g |
16.等物质的量的下列物质与足量稀硝酸反应,氧化产物伪Cu2-或SO42-还原产物为N0,消耗硝酸的量最多的是( )
| A. | Cu | B. | Cu2O | C. | CuS | D. | Cu2S |
6.在常温下,某兴趣小组模拟“侯氏制碱法”制取碳酸钠,流程如图1:
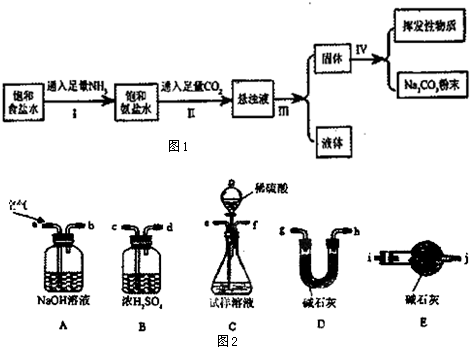
在常温下,有关物质的溶解度为:
(1)操作Ⅲ中的实验操作名称为过滤;
(2)操作I、II总反应的离子方程式为Na++NH3+CO2+H2O═NaHCO3↓+NH4+;
(3)操作I和II不能颠倒的原因由于NH3在饱和NaCl溶液中溶解量比CO2大,先通NH3,溶液呈碱性,更易吸收CO2,有利NaHCO3的生成,所以应先通入NH3;
(4)检验所得的碳酸钠粉末是否含有NaHCO3,的实验方案是(写出操作步骤、现象、结论):取少量产物于试管,加热,将产生的气体通入澄清石灰水,若使澄清石灰水变浑浊,证明有NaHCO3;
(5)为了测定所制取产物的纯度(假设杂质只有碳酸氢钠).该小组的实验步骤为:
i.使用下列装置组装实验装置,并检查气密性
ii.称取Wg产品放入C装置的锥形瓶中,加适量蒸馏水溶解
iii.称量D装置的质量为W1 g
iv.从分液漏斗滴入稀硫酸,直到不再产生气体为止
v.从a处缓缓鼓入一定量的空气,再次称量D装置质量为W2 g
vi.重复步骤v的操作,直到D装置的质量不再改变,称得D装置的质量为W3 g
根据上述实验回答如下问题:
①第i步,使用上述装置连接的接口顺序为:(b)→(e)(f)→(c)(d)→(g)(h)[或(h)(g)]→(i).
②第二个盛碱石灰装置的作用是防止空气进入D中碱石灰干扰实验.
③产物中碳酸钠和碳酸氢钠的物质的量之和为$\frac{{w}_{3}-{w}_{1}}{44}$mol.

在常温下,有关物质的溶解度为:
| 物质 | NH4Cl | NaHCO3 | Na2CO3 | NaCl |
| 溶解度/g | 37.2 | 9.6 | 21.5 | 36.0 |
(2)操作I、II总反应的离子方程式为Na++NH3+CO2+H2O═NaHCO3↓+NH4+;
(3)操作I和II不能颠倒的原因由于NH3在饱和NaCl溶液中溶解量比CO2大,先通NH3,溶液呈碱性,更易吸收CO2,有利NaHCO3的生成,所以应先通入NH3;
(4)检验所得的碳酸钠粉末是否含有NaHCO3,的实验方案是(写出操作步骤、现象、结论):取少量产物于试管,加热,将产生的气体通入澄清石灰水,若使澄清石灰水变浑浊,证明有NaHCO3;
(5)为了测定所制取产物的纯度(假设杂质只有碳酸氢钠).该小组的实验步骤为:
i.使用下列装置组装实验装置,并检查气密性
ii.称取Wg产品放入C装置的锥形瓶中,加适量蒸馏水溶解
iii.称量D装置的质量为W1 g
iv.从分液漏斗滴入稀硫酸,直到不再产生气体为止
v.从a处缓缓鼓入一定量的空气,再次称量D装置质量为W2 g
vi.重复步骤v的操作,直到D装置的质量不再改变,称得D装置的质量为W3 g
根据上述实验回答如下问题:
①第i步,使用上述装置连接的接口顺序为:(b)→(e)(f)→(c)(d)→(g)(h)[或(h)(g)]→(i).
②第二个盛碱石灰装置的作用是防止空气进入D中碱石灰干扰实验.
③产物中碳酸钠和碳酸氢钠的物质的量之和为$\frac{{w}_{3}-{w}_{1}}{44}$mol.
3.下列各组物质中,互为同系物的是( )
| A. | CH3-CH=CH2和 | B. | 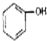 和 和 | C. |  和 和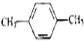 | D. | 乙酸和油酸 |
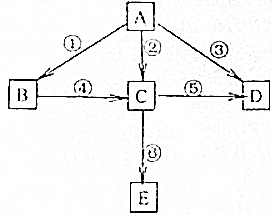 己知A为单质,B、C、D、E为化合物.它们之间存在如图转化关系:
己知A为单质,B、C、D、E为化合物.它们之间存在如图转化关系: 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.