题目内容
18.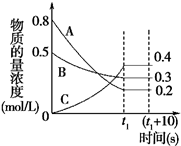 如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:(1)该反应的化学方程式为3A+B?2C.
(2)0~t1s 内B气体的平均反应速率为$\frac{0.2}{t{\;}_{1}}$mol/(L•s).
(3)(t1+10)s 时,A的转化率为75%,此时v(A)正>v(B)逆(填“>”、“<”或“=”).
(4)关于该反应的说法正确的是bc.
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为9:13.
分析 (1)由图象可知A、B的浓度降低,A、B为反应物,C的浓度增大为生成物,根据A、B、C的浓度变化量确定化学计量数,据此书写方程式;
(2)根据V=$\frac{△c}{△t}$进行计算;
(3)(t1+10)s 时,平衡没有发生移动,据A的转化率为$\frac{转化量}{起始量}$×100%计算;
(4)a.到达t1时刻该反应达平衡但没有停止;
b.在t1时刻之前,反应向正反应方向移动,据此判断;B气体的消耗速率大于它的生成速率
c.在t1时刻达平衡,正逆反应速率相等;C气体的正反应速率等于逆反应速率
(5)根据压强之比等于物质的量之比进行计算.
解答 解:(1)由图象可知A、B的浓度降低,A、B为反应物,A的浓度变化量为0.8mol/L-0.2mol/L=0.6mol/L,B的浓度变化量为0.5mol/L-0.3mol/L=0.2mol/L,C的浓度增大为生成物,C的浓度变化量为0.4mol/L,浓度变化量之比等于化学计量数之比,故A、B、C的化学计量数之比为0.6mol/L:0.2mol/L:0.4mol/L=3:1:2,故反应方程式为:3A+B?2C;故答案为:3A+B?2C;
(2)0~t1s 内B气体的平均反应速率V=$\frac{△c}{△t}$=$\frac{0.5-0.3}{t{\;}_{1}}$=$\frac{0.2}{t{\;}_{1}}$mol/(L•s),故答案为:$\frac{0.2}{t{\;}_{1}}$mol/(L•s);
(3)(t1+10)s 时,平衡没有发生移动,所以A的转化率为$\frac{0.8-0.2}{0.8}$×100%=75%,此时v(A)正=v(A)逆=3v(B)逆,所以v(A)正>v(B)逆,故答案为:75%;>;
(4)a.到达t1时刻该反应达平衡但没有停止,故错误;
b.在t1时刻之前,反应向正反应方向移动,所以B气体的消耗速率大于它的生成速率,故正确;
c.在t1时刻达平衡,正逆反应速率相等,所以C气体的正反应速率等于逆反应速率,故正确;
故选:bc;
(5)因为压强之比等于物质的量之比,所以容器中(t1+10)s时的压强与起始时的压强之比为$\frac{0.4+0.3+0.2}{0.8+0.5}$=9:13,故答案为:9:13.
点评 本题考查平衡图象、化学平衡有关计算、平衡状态的判断等,难度不大,注意基础知识的理解掌握.

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案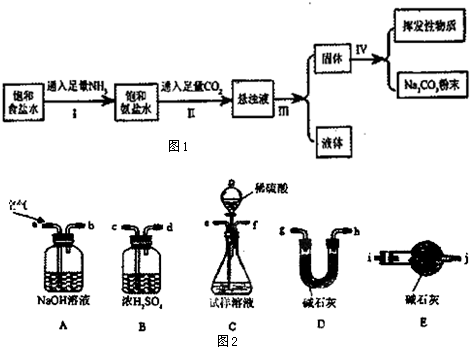
在常温下,有关物质的溶解度为:
| 物质 | NH4Cl | NaHCO3 | Na2CO3 | NaCl |
| 溶解度/g | 37.2 | 9.6 | 21.5 | 36.0 |
(2)操作I、II总反应的离子方程式为Na++NH3+CO2+H2O═NaHCO3↓+NH4+;
(3)操作I和II不能颠倒的原因由于NH3在饱和NaCl溶液中溶解量比CO2大,先通NH3,溶液呈碱性,更易吸收CO2,有利NaHCO3的生成,所以应先通入NH3;
(4)检验所得的碳酸钠粉末是否含有NaHCO3,的实验方案是(写出操作步骤、现象、结论):取少量产物于试管,加热,将产生的气体通入澄清石灰水,若使澄清石灰水变浑浊,证明有NaHCO3;
(5)为了测定所制取产物的纯度(假设杂质只有碳酸氢钠).该小组的实验步骤为:
i.使用下列装置组装实验装置,并检查气密性
ii.称取Wg产品放入C装置的锥形瓶中,加适量蒸馏水溶解
iii.称量D装置的质量为W1 g
iv.从分液漏斗滴入稀硫酸,直到不再产生气体为止
v.从a处缓缓鼓入一定量的空气,再次称量D装置质量为W2 g
vi.重复步骤v的操作,直到D装置的质量不再改变,称得D装置的质量为W3 g
根据上述实验回答如下问题:
①第i步,使用上述装置连接的接口顺序为:(b)→(e)(f)→(c)(d)→(g)(h)[或(h)(g)]→(i).
②第二个盛碱石灰装置的作用是防止空气进入D中碱石灰干扰实验.
③产物中碳酸钠和碳酸氢钠的物质的量之和为$\frac{{w}_{3}-{w}_{1}}{44}$mol.
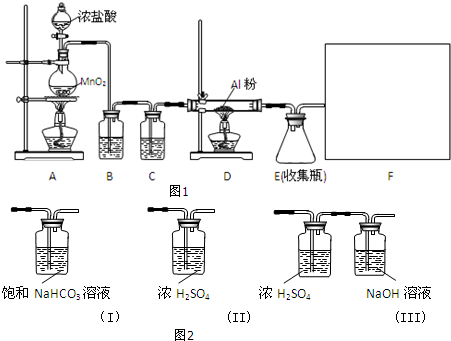
(1)A装置中发生反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B的作用是除去Cl2中混有的HCl气体.
(3)请给标记为F的实线方框选择合适的装置(图2)III.
(4)AlCl3遇潮湿空气即产生大量白雾的原因是AlCl3遇水水解,Al3++3H2O?Al(OH)3+3H+,产生的氯化氢气体在空气中形成酸雾(结合离子方程式说明).
(5)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案.方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定.实验中所用NaOH溶液浓度为0.2000mol•L-1,以下是实验记录与数据处理.
 | 1 | 2 | 3 | 4 |
| V( 样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
| V(NaOH)(终读数) | 22.60 | 22.25 | 22.05 | 23.00 |
②在本实验的滴定过程中,下列操作会使实验结果偏小的是df(填写序号).
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动.有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视
(6)工业上常见的制备方法有四种:
a.由金属铝和氯气制取:2Al+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3
b.由无水氯化氢气体与熔融金属铝制取:2Al+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3H2↑
c.用碳氯化法制取:Al2O3+3C+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO
d.用氧化铝和四氯化碳反应制取:Al2O3+3CCl4═2AlCl3+3COCl2↑(光气,一种无色剧毒气体)
则有关以上四种方法的叙述正确的是CD
A.在四个反应中AlCl3均为氧化产物
B.反应b可以改写成离子方程式2Al+6H+═2Al3++3H2↑
C.反应c中每产生2mol AlCl3时转移电子数为6NA(NA代表阿伏加德罗常数的值)
D.反应c、d容易造成大气污染.
| A. | CH3-CH=CH2和 | B. | 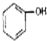 和 和 | C. |  和 和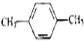 | D. | 乙酸和油酸 |
 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 可与溴水反应,且1 mol该物质与足量溴水反应消耗6 mol Br2 | |
| B. | 可与NaOH溶液反应,1 mol该物质可与5 mol NaOH反应 | |
| C. | 一定条件下1 mol该物质可与H2加成,耗H2最大量为6 mol | |
| D. | 维生素P能发生水解反应 |
| A. | 在钠与氯气的反应中,1mol钠失去电子的数目为2NA | |
| B. | 14g氮气所含的氮原子数为NA | |
| C. | 标准状况下,22.4 L水所含的水分子数为NA | |
| D. | 1mol任何物质所含的分子数均为NA |
| A. | 溴苯中混有Br2,将其倒入NaOH溶液中,振荡,静置,分液 | |
| B. | 乙烷中混有乙烯,在一定条件下通入足量的氢气进行反应,使乙烯转化为乙烷 | |
| C. | 乙酸乙酯中混有乙酸,可加入一定量的乙醇,在浓硫酸存在的条件下加热使乙酸酯化 | |
| D. | 乙烯中混有SO2和CO2,将其通入溴水进行洗气 |