题目内容
13.下列说法中不正确的是( )| A. | 浓硫酸能与灼热的木炭反应,生成二氧化碳和二氧化硫 | |
| B. | 浓硫酸具有吸水性,在实验室中常用作干燥剂 | |
| C. | 常温下,可以用铁质或铝质容器储存浓硫酸或浓硝酸 | |
| D. | 浓硫酸与铜反应产生的气体对环境无影响 |
分析 浓硫酸具有吸水性,可用作干燥剂,具有脱水性,可使蔗糖碳化而变黑,具有强氧化性,可与碳、铜在加热条件下反应,与铝、铁等金属在常温下发生钝化作用,以此解答.
解答 解:A.浓硫酸具有强氧化性,可与碳在加热条件下反应生成二氧化碳和二氧化硫气体,故A正确;
B.浓硫酸具有吸水性,可用作干燥剂,但只能干燥酸性、中性且与浓硫酸不发生反应的气体,故B正确;
C.浓硫酸与铝、铁等金属在常温下发生钝化作用,在表面形成一层致密的氧化物膜,阻碍反应的继续进行,故C正确;
D.铜和浓硫酸在加热条件下反应生成硫酸铜和二氧化硫,二氧化硫污染环境,故D错误;
故选D.
点评 本题考查浓硫酸的性质,为元素化合物中高频考点,侧重于基础知识的综合考查和运用,难度不大,注意相关基础知识的积累.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
3.将铁屑溶于过量盐酸后,再加入下列物质,没有+3价铁离子生成的是( )
| A. | 稀硫酸 | B. | 氯水 | C. | 硝酸锌 | D. | 双氧水 |
4.下列分离与提纯物质的实验操作中错误的是( )
| A. | 萃取时,要求萃取剂的密度比水的密度大 | |
| B. | 蒸馏时,温度计水银球与蒸馏烧瓶支管口相平 | |
| C. | 过滤时,要将待过滤混合物转移到漏斗中 | |
| D. | 分液时,分液漏斗的下口必须紧贴在烧杯壁上 |
1.锶(Sr)位于第五周期第ⅡA族,下来关于锶及其化合物的性质推断错误的是( )
| A. | Sr能与水反应,生成氢气 | |
| B. | Sr(OH)2具有两性 | |
| C. | SrSO4在水中溶解度很小 | |
| D. | SrCl2溶液和Na2CO3溶液能发生反应 |
8.某短周期元素最外层上只有2个电子,该元素( )
| A. | 一定是金属元素 | |
| B. | 一定是ⅡA族元素 | |
| C. | 一定是非金属元素 | |
| D. | 可能是金属元素也可能是非金属元素 |
18.区别CH4和C2H4的方法最好是( )
| A. | 通入溴水中观察溶液颜色的变化 | B. | 嗅闻它们的气味 | ||
| C. | 比较它们在水中的溶解度大小 | D. | 点燃它们后,观察火焰 |
5. Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)化学反应速率本质上是由反应物本身的性质决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明温度对反应速率有影响,该因素对反应速率的具体影响是:其它条件相同时,温度越高反应速率越快.
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2.0mol/L.
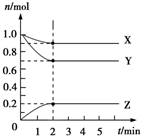
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
(5)反应开始至2min,Y的平均反应速率0.03mol/(L•min).
(6)分析有关数据,写出X、Y、Z的反应方程式X(g)+3Y(g)?2Z(g).
 Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2.0mol/L.
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
(5)反应开始至2min,Y的平均反应速率0.03mol/(L•min).
(6)分析有关数据,写出X、Y、Z的反应方程式X(g)+3Y(g)?2Z(g).
2.下列有关反应速率的说法正确的是( )
| A. | 用铁片和稀硫酸反应制氢气时,滴入几滴硫酸铜溶液可以加快反应速率 | |
| B. | 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢 | |
| C. | SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 | |
| D. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |