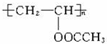
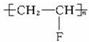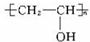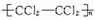题目内容
3.能说明醋酸是弱电解质的是:( )①pH=2的醋酸溶液稀释至体积为原来的100倍后pH<4
②稀的醋酸溶液中加入少量的醋酸铵固体,溶液的酸性减弱(醋酸铵溶于水显中性)
③可以用食醋清除热水瓶内的水垢.
| A. | ①③ | B. | ①② | C. | ②③ | D. | 全部 |
分析 要证明醋酸为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
解答 解:①pH=2的醋酸溶液稀释至体积为原来的100倍后PH<4,说明存在电离平衡,应为弱酸,如为强酸,则pH=4,故正确;
②稀的醋酸溶液中加入少量的醋酸铵固体,溶液的酸性减弱,说明氢离子浓度减小,溶液存在平衡移动,说明醋酸为弱酸,故正确;
③食醋能清除水垢,说明醋酸的酸性比碳酸强,但不能说明醋酸是弱电解质,故错误.
故选B.
点评 本题考查弱电解质的判断,注意弱电解质是不能完全电离的,一般利用电离平衡和盐的水解平衡来判断弱电解质,难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
13.下列说法中不正确的是( )
| A. | 浓硫酸能与灼热的木炭反应,生成二氧化碳和二氧化硫 | |
| B. | 浓硫酸具有吸水性,在实验室中常用作干燥剂 | |
| C. | 常温下,可以用铁质或铝质容器储存浓硫酸或浓硝酸 | |
| D. | 浓硫酸与铜反应产生的气体对环境无影响 |
14.当光束通过某红褐色液体时,从侧面可观察到一条光亮的“通路”,该红褐色液体是( )
| A. | 溶液 | B. | 胶体 | C. | 悬浊液 | D. | 乳浊液 |
18.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4 ④失电子能力:Na>Mg>Al.
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4 ④失电子能力:Na>Mg>Al.
| A. | ②④ | B. | ①④ | C. | ②③ | D. | ①② |
8.下列有关说法正确的是( )
| A. | H2SO4的酸性比HClO的酸性强,所以S的非金属性比Cl强 | |
| B. | Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物,所以Al比Mg活泼 | |
| C. | H2S 300℃时开始分解,H2O 1000℃时开始分解,说明O的非金属性比S强 | |
| D. | Na和Mg与酸都能激烈反应放出氢气,故无法比较它们的金属性强弱 |
15.短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13.X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | 元素Z、W的简单离子的电子层结构不同 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是酸,也可能是盐 |
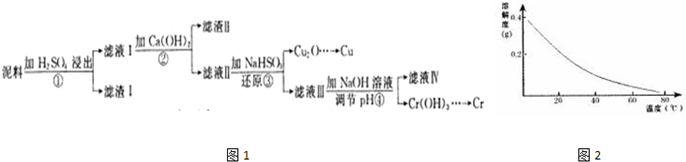
12.铜、铬都是用途广泛的金属.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如图1,CaSO4的溶解度曲线如图2.
 已知:部分物质沉淀的pH如表:
已知:部分物质沉淀的pH如表:
请回答下列问题:
(1)滤液I中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为3.2<pH≤4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O.
(4)当离子浓度≤1×10-5mol•L-1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值经计算为5.6.则得出该值时还必须提供的数据是:溶度积常数.
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式:Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
 已知:部分物质沉淀的pH如表:
已知:部分物质沉淀的pH如表:| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(1)滤液I中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为3.2<pH≤4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O.
(4)当离子浓度≤1×10-5mol•L-1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值经计算为5.6.则得出该值时还必须提供的数据是:溶度积常数.
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式:Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
13.下列有关化学基本概念的叙述中正确的是( )
| A. | 可溶性盐的水溶液一定呈中性 | |
| B. | 离子化合物中一定含有金属元素 | |
| C. | 氧化还原反应中一定有元素化合价的升降 | |
| D. | 强电解质溶液的导电性一定强于弱电解质溶液的导电性 |