题目内容
硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3,再用NaIO3按下列反应(未配平)来制取单质I2.NaIO3来源于自然界的矿物.
①NaIO3+NaHSO3-NaI+Na2SO4+H2SO4
②IO
+I-+H+-I2+H2O
(1)配平上述反应 .
(2)在含5mol NaHSO3的溶液中逐滴加入NaIO3溶液.请计算开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是多少?
(3)25℃时,H2SO3═HSO
+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,
的值 ;加入少量水,水的电离程度将 .
①NaIO3+NaHSO3-NaI+Na2SO4+H2SO4
②IO
- 3 |
(1)配平上述反应
(2)在含5mol NaHSO3的溶液中逐滴加入NaIO3溶液.请计算开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是多少?
(3)25℃时,H2SO3═HSO
- 3 |
| c(H2SO3) | ||
c(HS
|
c(S
| ||
c(HS
|
考点:氧化还原反应的计算,化学方程式的有关计算,弱电解质在水溶液中的电离平衡
专题:计算题
分析:(1)两个反应均为氧化还原反应,由电子守恒及原子守恒分析;
(2)由已知的两个反应判断生成碘时NaIO3的物质的量;
(3)NaHSO3的水解平衡常数Kh=
,向NaHSO3溶液中加入少量的I2,HSO3-的还原性比I-强,发生氧化还原反应H2O+I2+HSO3-=2I-+SO42-+3H+;加入NaOH,发生NaHSO3+NaOH═Na2SO3+H2O;加水促进电离,以此来解答.
(2)由已知的两个反应判断生成碘时NaIO3的物质的量;
(3)NaHSO3的水解平衡常数Kh=
| Kw |
| Ka |
解答:
解:(1)NaIO3+NaHSO3-NaI+Na2SO4+H2SO4中,I元素的化合价由+5价降低为-1价,S元素的化合价由+4价升高为+6价,由电子守恒和原子守恒可得2NaIO3+6NaHSO3=2NaI+3Na2SO4+3H2SO4;IO3-+I-+H+-I2+H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,则由电子守恒和原子守恒得到IO3-+5I-+6H+=3I2+3H2O,故答案为:2NaIO3+6NaHSO3=2NaI+3Na2SO4+3H2SO4、IO3-+5I-+6H+=3I2+3H2O;
(2)由2NaIO3+6NaHSO3=2NaI+3Na2SO4+3H2SO4可知,5mol NaHSO3恰好完全反应开始生成碘,则NaIO3的物质的量为5×
=
mol;
由IO3-+5I-+6H+=3I2+3H2O可知,产生单质I2最大值时,二者完全反应,
IO3-+3HSO3-═3SO42-+I-+3H+,
1 3 1
5
IO3-+5I-+6H+=3I2+3H2O
1 5
x
x=
mol,则共消耗NaIO3的物质的量为
mol+
mol=2mol,
答:开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是
mol、2mol;
(3)NaHSO3的水解平衡常数Kh=
=1.0×10-12,向NaHSO3溶液中加入少量的I2,HSO3-的还原性比I-强,发生氧化还原反应H2O+I2+HSO3-=2I-+SO42-+3H+,c(H+)增大,由Ka=1×10-2mol/L=
可知,溶液中
将增大;加入NaOH,发生NaHSO3+NaOH═Na2SO3+H2O,则
的值增大,加水促进电离,则水的电离程度增大,故答案为:1.0×10-12;增大;增大;增大.
(2)由2NaIO3+6NaHSO3=2NaI+3Na2SO4+3H2SO4可知,5mol NaHSO3恰好完全反应开始生成碘,则NaIO3的物质的量为5×
| 2 |
| 6 |
| 5 |
| 3 |
由IO3-+5I-+6H+=3I2+3H2O可知,产生单质I2最大值时,二者完全反应,
IO3-+3HSO3-═3SO42-+I-+3H+,
1 3 1
5
| 5 |
| 3 |
IO3-+5I-+6H+=3I2+3H2O
1 5
x
| 5 |
| 3 |
x=
| 1 |
| 3 |
| 5 |
| 3 |
| 1 |
| 3 |
答:开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是
| 5 |
| 3 |
(3)NaHSO3的水解平衡常数Kh=
| Kw |
| Ka |
| c(H+)c(HSO3-) |
| c(H2SO3) |
| c(H2SO3) | ||
c(HS
|
c(S
| ||
c(HS
|
点评:本题考查氧化还原反应的计算及电离平衡常数的计算,为高频考点,把握氧化还原反应中电子守恒及Ka只与温度有关为解答的关键,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
下列属于电解质的一组是( )
①CuSO4 ②氧化钠 ③水银 ④SO3 ⑤氯水 ⑥酒精 ⑦NaOH.
①CuSO4 ②氧化钠 ③水银 ④SO3 ⑤氯水 ⑥酒精 ⑦NaOH.
| A、①⑦ | B、①②⑦ |
| C、①④⑦ | D、①③⑤⑦ |
下列实验能成功的是①用灼烧法鉴别Na2CO3固体和NaHCO3固体 ②用观察法区别Na2O粉末和Na2O2粉末 ③用AlCl3溶液鉴别Na2CO3溶液和NaOH溶液 ④用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液( )
| A、全部 | B、①②④ |
| C、②③④ | D、①②③ |
下列有关说法正确的是( )
| A、单质Na可通过电解NaCl溶液制得 |
| B、石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
| C、常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D、25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.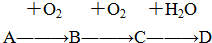 A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去):
A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去):