题目内容
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).
(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为 .
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为 .
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如图1:
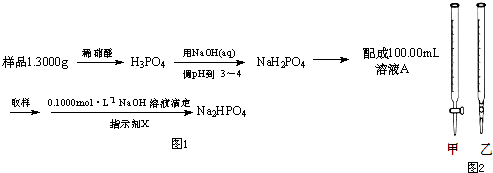
①滴定时所用的指示剂X可为 .
②NaOH标准溶液应盛放在图2所示的滴定管 (选填:“甲”或“乙”) 中.
③滴定实验记录如下表(样品中杂质不与酸或碱反应).
试计算样品中Na5P3O10的质量分数(列出计算过程,结果保留三位有效数字).
(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如图1:

①滴定时所用的指示剂X可为
②NaOH标准溶液应盛放在图2所示的滴定管
③滴定实验记录如下表(样品中杂质不与酸或碱反应).
| 滴定次数 | 待测溶液A的体积(/mL) | 0.1000mol?L-1 NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
考点:探究物质的组成或测量物质的含量,离子方程式的书写
专题:实验设计题,离子反应专题
分析:(1)NaH2PO4溶液显弱酸性,说明H2PO4-在水溶液里电离程度大于水解程度;
(2)Na2HPO4溶液显弱碱性,说明HPO42-的水解程度大于电离程度;
(3)①NaH2PO4溶液显弱酸性,应该用酚酞作指示剂;
②碱只能用碱式滴定管量取;
③A中成分是NaH2PO4,能和氢氧化钠反应生成Na3PO4,反应方程式为NaH2PO4+NaOH=Na3PO4+H2O,氢氧化钠的平均体积=
mL=20.00mL,根据方程式计算A的物质的量浓度,再根据P原子守恒计算Na5P3O10的质量分数.
(2)Na2HPO4溶液显弱碱性,说明HPO42-的水解程度大于电离程度;
(3)①NaH2PO4溶液显弱酸性,应该用酚酞作指示剂;
②碱只能用碱式滴定管量取;
③A中成分是NaH2PO4,能和氢氧化钠反应生成Na3PO4,反应方程式为NaH2PO4+NaOH=Na3PO4+H2O,氢氧化钠的平均体积=
| (21.03-1.02)+(21.99-2.00)+(20.20-0.20) |
| 3 |
解答:
解:(1)NaH2PO4溶液显弱酸性,说明H2PO4-在水溶液里电离程度大于水解程度,该阴离子电离方程式为H2PO4-?HPO42-+H+,故答案为:H2PO4-?HPO42-+H+;
(2)Na2HPO4溶液显弱碱性,说明HPO42-的水解程度大于电离程度,该阴离子水解方程式为HPO42-+H2O?H2PO4-+OH-,故答案为:HPO42-+H2O?H2PO4-+OH-;
(3)①NaH2PO4溶液显弱酸性,应该用酚酞作指示剂,滴定终点时颜色变化明显,故答案为:酚酞;
②氢氧化钠溶液呈碱性,应该用碱式滴定管乙盛放,故选乙;
③A中成分是NaH2PO4,能和氢氧化钠反应生成Na3PO4,反应方程式为NaH2PO4+NaOH=Na2HP4+H2O,氢氧化钠的平均体积=
mL=20.00mL,根据方程式得c(A)=
=0.0800mol/L,100mL溶液中n(A)=0.008mol,根据P原子守恒得m(Na5P3O10)=0.008mol÷3×368g/mol=0.9813g,质量分数=
×100%=75.5%,
故答案为:75.5%.
(2)Na2HPO4溶液显弱碱性,说明HPO42-的水解程度大于电离程度,该阴离子水解方程式为HPO42-+H2O?H2PO4-+OH-,故答案为:HPO42-+H2O?H2PO4-+OH-;
(3)①NaH2PO4溶液显弱酸性,应该用酚酞作指示剂,滴定终点时颜色变化明显,故答案为:酚酞;
②氢氧化钠溶液呈碱性,应该用碱式滴定管乙盛放,故选乙;
③A中成分是NaH2PO4,能和氢氧化钠反应生成Na3PO4,反应方程式为NaH2PO4+NaOH=Na2HP4+H2O,氢氧化钠的平均体积=
| (21.03-1.02)+(21.99-2.00)+(20.20-0.20) |
| 3 |
| 0.1000mol/L×0.02000L |
| 0.02500L |
| 0.9813g |
| 1.3000g |
故答案为:75.5%.
点评:本题考查了物质含量的测定及物质的性质,根据物质之间的反应结合原子守恒计算物质含量,计算量较大,注意小数的保留,难度较大.

练习册系列答案
相关题目
下列有关化学研究的正确说法是( )
| A、同时改变两个变量来研究反应速率的变化,能更快得出有关规律 |
| B、对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 |
| C、Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
| D、根据氧化物的组成元素将氧化物分成酸性氧化物碱性氧化物和两性氧化物 |
反应3H2(g)+N2(g)?2NH3(g)△H=-46.19kJ?mol-1,关于这个反应的平衡常数K,下列说法正确的是( )
| A、随温度升高K增加 |
| B、随压强升高K增加 |
| C、随温度升高K减小 |
| D、随压强升高K减小 |
分别将下列物质:①FeCl3②Na2O2③NaCl④Ca(HCO3)2投入水中,对其溶液加热蒸干,仍能得到原物质的是( )
| A、①②③ | B、①③ | C、③④ | D、③ |
 请认真观察图,然后回答问题.
请认真观察图,然后回答问题.