题目内容
16.质量分数为a%,物质的量浓度为c1mol/L的稀硫酸蒸发水后,其质量分数变为2a%,此时物质的量浓度为c2mol/L,则c1与c2的关系为( )| A. | c2=2c1 | B. | c2<2c1 | C. | c2>2c1 | D. | c1=2c2 |
分析 稀硫酸蒸发水前后,H2SO4的质量和物质的量不变,且硫酸浓度越高,密度越大;设出分别蒸发前后溶液质量、体积、密度,然后根据溶质质量分数、物质的量浓度的表达式列式计算即可.
解答 解:稀硫酸蒸发水前后,H2SO4的质量和物质的量不变,
假设蒸发前溶液质量为m1,体积为V1,则密度为ρ1=$\frac{{m}_{1}}{{V}_{1}}$,H2SO4的质量为m1×a%,H2SO4的物质的量为V1×c1%,
蒸发后溶液质量为m2,体积为V2,则密度为ρ2=$\frac{{m}_{2}}{{V}_{2}}$,H2SO4的质量为m2×2a%,H2SO4的物质的量为V2×c2%,
可得:m1×a%=m2×2a% ①,V1×c1%=V2×c2% ②,
整理可得:m1=2m2 ③,
又因为硫酸浓度越高,密度越大,即蒸发后的硫酸密度大于蒸发前的硫酸密度:ρ1<ρ2,即:$\frac{{m}_{1}}{{V}_{1}}$<$\frac{{m}_{2}}{{V}_{2}}$④,
将③式代入④式得到:$\frac{2{m}_{2}}{{V}_{1}}$<$\frac{{m}_{2}}{{V}_{2}}$,则:2V2<V1 ⑤,
再由②式可得:V1=V2×$\frac{{c}_{2}}{{c}_{1}}$ ⑥,
将⑥式代入⑤式得:2V2<V2×$\frac{{c}_{2}}{{c}_{1}}$,
整理可得:$\frac{{c}_{2}}{{c}_{1}}$>2,
即:2c1<c2,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度、溶质质量分数的概念为解答关键,注意硫酸的浓度越高,密度越大,试题培养了学生的化学计算能力.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
4.对于容积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g);△H<0,在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述不正确的是( )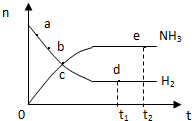

| A. | 点a处的正反应速率比点b处的大 | |
| B. | 点c处的正反应速率与逆反应速率相等 | |
| C. | 点d(t1时刻)的n(N2)比点e(t2时刻)处的n(N2)大 | |
| D. | 其他条件不变,773K下反应至t1时刻,此时画出的两根平行线间的距离将要变小 |
1.下列表达中不正确的是( )
| A. | 1molH2 | B. | 2 molNa2CO3 | C. | 0.5mol氧 | D. | 2 molOH- |
8.下列各组离子在无色酸性溶液中能大量共存的是( )
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、K+、SO42-、Cl- |
5.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
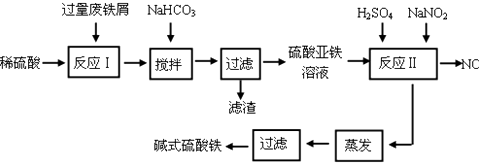
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
(1)如何加快废铁屑的溶解,写出两种办法搅拌、加热.
(2)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(3)反应Ⅱ中加入NaNO2的目的是将亚铁离子氧化为铁离子.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为C.
A.氯水 B.KSCN溶液 C.酸性KMnO4溶液 D.NaOH溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素的总含量为g/L.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”).

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)如何加快废铁屑的溶解,写出两种办法搅拌、加热.
(2)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(3)反应Ⅱ中加入NaNO2的目的是将亚铁离子氧化为铁离子.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为C.
A.氯水 B.KSCN溶液 C.酸性KMnO4溶液 D.NaOH溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素的总含量为g/L.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”).
6.已知298K时,2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-1.在该温度下,向某密闭恒定体积的容器中通入2mol SO2和1mol O2达到平衡时,SO3为0.6mol,如果此时移走1mol SO2和0.5mol O2,在相同温度下再达到平衡时SO3的物质的量是( )
| A. | 0.3mol | B. | 小于0.3mol | ||
| C. | 大于0.3mol,小于0.6mol | D. | 大于0.6mol |